Identifiquen un nou mecanisme de regulació de les proteïnes
Un estudi liderat per David Reverter, investigador de l’IBB i del Departament de Bioquímica i de Biologia Molecular de la UAB, ha identificat un nou mecanisme de regulació d’un enzim que controla la vida mitjana de les proteïnes cel·lulars. L’estudi ha estat publicat a la prestigiosa revista Nature Communications.
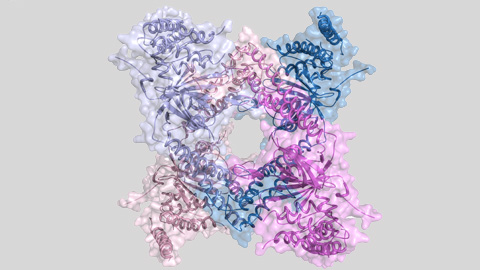
En el treball que els investigadors acaben de publicar en la revista Nature Communications presenten la caracterització estructural i el descobriment d’un nou mecanisme de regulació d’un enzim que talla les cadenes d’ubiquitina, que s’anomena USP25. Aquest enzim elimina les cadenes d’ubiquitina de les proteïnes marcades i té un impacte important en la seva funció cel·lular en evitar que siguin degradades pel proteosoma.
L’estructura tridimensional d’aquest enzim, obtinguda gràcies a la cristal·lografia de proteïnes i a la llum del sincrotró ALBA, ha permès observar la presència d’un assemblatge proteic amb dos tipus diferents d’estructura quaternària: tetràmer i dímer. I el que és més important, el tetràmer és inactiu i el dímer és actiu. Per tant l’alternança entre aquests dos assemblatges regula l’activitat d’aquest enzim i, de retruc, el temps de vida d’importants proteïnes cel·lulars.
L’estudi s’ha realitzat en el laboratori del Dr. David Reverter, que dirigeix el grup d’estructura de proteïnes del Institut de Biotecnologia i Biomedicina de la UAB (IBB), i també hi ha col·laborat el grup de la Dra. Virginia Amador, del centre de recerca biomèdica IDIBAPS, a l’Hospital Clínic. El primer autor del treball ha estat el Dr. Bing Liu, vinculat també a l’IBB i al Departament de Bioquímica i de Biologia Molecular de la UAB.
Referència:
Liu, B., Surena-Gomez, M., Zhen, Y., Amador, V., Reverter, D. A quaternary tetramer assembly inhibits the deubiquitinating activity of USP25. Nature Communications (2018). DOI: 10.1038/s41467-018-07510-5.