Microscòpia Òptica (OM)
La creació del primer microscopi simple d’Anton van Leeuwenhoek a finals del segle XVII va suposar una revolució científica, ja que va permetre endinsar-se en un món microscòpic fins aleshores inexplorat. Des d’aquell moment, els microscopis òptics han evolucionat enormement i han aparegut noves tecnologies. Aquesta impressionant evolució tecnològica ha fet que la microscòpia òptica no hagi quedat enrere i continuï essent igual de necessària, permetent estudis d’elevat interès científic.
L’àrea d’OM ofereix laboratoris amb campanes de flux laminar vertical, incubadors, bany maria, autoclau, així com centrífugues i material fungible per a muntar les mostres.
El personal de l’àrea també proporciona assessorament cientificotècnic per optimitzar i/o dissenyar experiments, així com per desenvolupar noves aplicacions. A més, ofereix capcitació als usuaris que vulguin utilitzar l’equipament en règim d’autoservei.
Serveis

La caracterització per estereomicroscòpia és una tècnica d’observació visual que permet examinar mostres a magnificació baixa i mitjana amb visió tridimensional. Diferents modalitats d’il·luminació ofereixen opcions específiques: llum transmesa per estructures internes de mostres primes, llum reflectida per superfícies opaques i textures, llum polaritzada per revelar variacions en mostres anisotròpiques, i fluorescència per visualitzar components que emeten llum quan són excitats.
Càmeres disponibles: Hamamatsu ORCA Flash 4.0 LT (sensor CMOS monocrom) i Axiocam 305 (sensor CMOS en color).
- Leica MZ FLIII
La microscòpia de camp ampli il·lumina tota la mostra amb llum blanca o específica, i permet obtenir imatges 2D ràpides de tot el volum. Tot i això, també recull informació fora de focus, la qual cosa pot reduir contrast i nitidesa. Els nostres microscopis permeten fer, a més, imatges per camp clar i per contrast d’interferència diferencial (DIC). És una tècnica particularment indicada per a estudis amb cèl·lules vives, estudis en seqüència temporal i cribratge d’alt rendiment.
Càmeres disponibles: Hamamatsu ORCA Flash 4.0 LT (sensor CMOS monocrom) i Axiocam 305 (sensor CMOS en color).
- Olympus IX81 (integrat a l’Olympus FV1000)
- Axio Observer 7 (integrat al ZEISS LSM 980)
Lisosomes transfectats amb tecnologia BacMam expressant GFP.
La microscòpia confocal utilitza un làser que escaneja la mostra punt a punt i un pinhole que elimina la llum fora de focus, que permeten obtenir imatges 2D nítides i d’alt contrast de plans específics. Les imatges digitalitzades poden ser usades per a reconstruccions i anàlisis 3D d’objectes amb organització complexa. Tot i ser més lenta que la microscòpia de camp ampli, és especialment útil per a imatges tridimensionals, anàlisi múltiplex, quantificació de fluorescència i estudis de co-localització.
- Olympus FV1000
- Leica TCS SP5
- Zeiss LSM 980
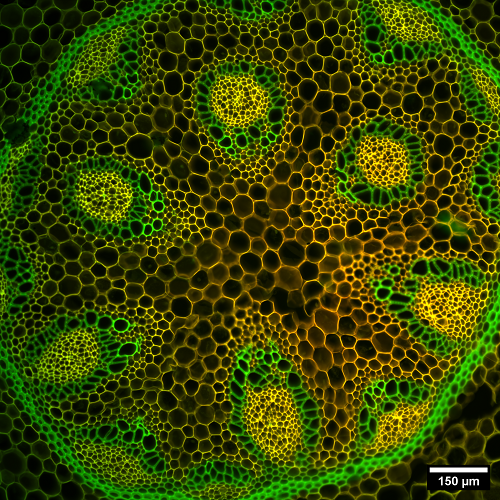
A) Rizoma de "Convallaria majalis". B) Detall d'una secció de ronyó de ratolí. Crèdit: Servei de Microscòpia, UAB
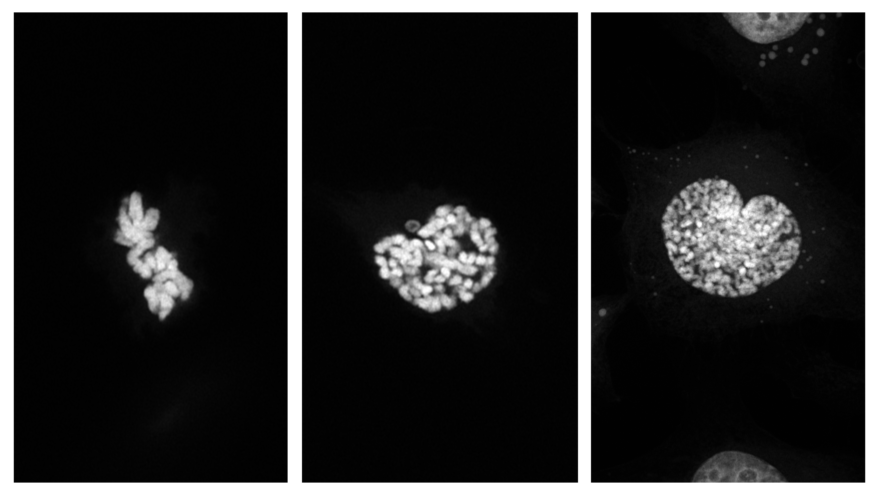
Experiment per avaluar els pics de calci que generen les cèl·lules degut a una estímul determinat. Cortesia: Nour Al Bast (Carme Nogués, Departament de Biologia Cel·lular, UAB).
Són aquells que permeten l’estudi de dinàmiques cel·lulars, d’orgànuls o de canvis iònics, també coneguts com a in vivo imaging. És important que l’usuari conegui l’escala temporal en què es dona l’esdeveniment per tal de poder ajustar l’equip.
La microscòpia confocal de superresolució amb Airyscan 2 millora la resolució espacial i la sensibilitat respecte a la confocal tradicional (~140 nm lateral vs. ~250 nm). Utilitza un detector multielement (Airyscan 2) que recull més fotons i redueix el soroll de fons, combinat amb processament computacional per obtenir imatges més nítides i detallades. Permet adquirir entre 2 i 8 línies d’imatge simultànies, incrementant la velocitat sense perdre qualitat, i ofereix una gran flexibilitat experimental. Això fa que sigui interessant per visualitzar orgànuls cel·lulars amb més detall, estudis de colocalització amb precisió millorada, seguiment de dinàmiques cel·lulars i reconstrucció de teixits o cèl·lules amb alta definició.
- Airyscan 2 integrat al ZEISS LSM 980
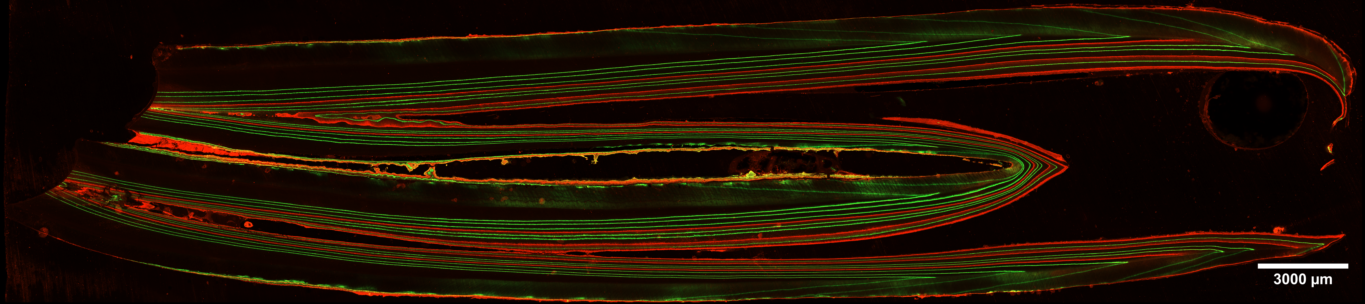
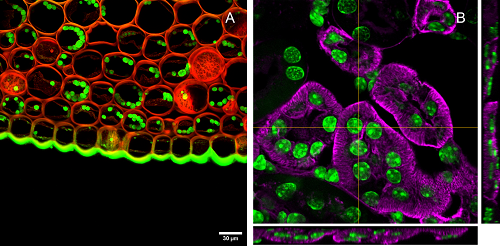
Mapeig de la mostra de manera automatitzada, tant amb confocal com amb camp ample, obtenint aquesta manera la informació de la totalitat de la mostra.
FLIM (Fluorescence Lifetime Imaging Microscopy): Aquesta tècnica permet obtenir imatges basades no en l’espectre d’emissió ni en la intensitat del senyal d’una molècula fluorescent o d’un fluoròfor, sinó en les diferències en el temps de vida mitjana de la fluorescència. El temps de vida fa referència al període durant el qual una molècula fluorescent roman en l’estat excitat abans d’emetre un fotó. FLIM és especialment útil per a conèixer la distribució espacial d’un marcatge i del neu nano-ambient. A més, com que el temps de vida és característic per a cada fluoròfor, permet distingir aquells marcatges que siguin espectralment molt propers, així com també diferenciar-lo d’una autofluorescència present a la mostra.
FLIM-FRET: FRET (Förster Resonance Energy Transfer) és una tècnica per estudiar les interaccions moleculars que precisa d’una molècula donadora i d’una acceptora d’energia. En el cas de FLIM-FRET només es requereix de la mesura del temps de vida del donador que, en el cas de donar-se el fenomen de FRET, el temps de vida del donador s’escurçarà.
Anisotropia de Fluorescència: És un fenomen en què la llum emesa per un fluoròfor mostra diferències d’intensitat segons els diferents eixos de polarització, a causa de la direccionalitat de l’emissió respecte a l’excitació. Aquesta tècnica s'utilitza per mesurar processos que impliquen canvis en la rotació molecular, com ara la unió de lligands, canvis conformacionals de proteïnes o cinètiques de reaccions biomoleculars. Quan una molècula canvia la seva mida o mobilitat, també canvia la seva capacitat de rotar durant el temps d’excitació, fet que es reflecteix en la variació de l’anisotropia.
FCS (Fluorescence Correlation Spectroscopy): És l’anàlisi temporal de la fluctuació de la intensitat de fluorescència en un petit volum (fl). Una de les aplicacions d’aquest anàlisi és el càlcul de les fluctuacions de concentració de partícules fluorescents en solució.
FRAP (Fluorescence Recovery After Photobleaching): És una tècnica de fluorescència àmpliament utilitzada per quantificar la mobilitat de molècules dins les cèl·lules. El mètode es basa en l’extinció irreversible (fotoblanqueig) d’un conjunt de molècules en una petita regió de la mostra, mitjançant una il·luminació intensa. A continuació, es monitoritza la recuperació de la intensitat de fluorescència en aquesta regió, la qual es produeix gràcies al desplaçament de molècules fluorescents no fotoblanquejades cap a la zona d’interès.
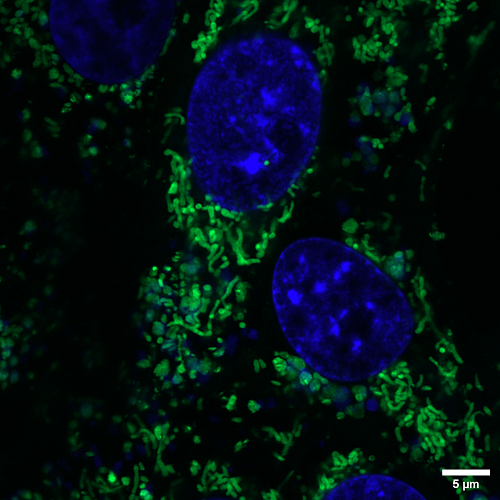
Cèl·lules HeLa marcades amb ConcanavalinaA-488, podent-se observar la membrana i el tràfic vesicular. Crèdit: SMiDRX, UAB
La TIRFM (Total Internal Reflection Fluorescence Microscopy) utilitza una ona evanescent que excita fluoròfors només a la regió molt propera a la interfície vidre-aigua (~100 nm), aconseguint alta resolució axial. És una tècnica òptima per a estudis de membrana cel·lular en cèl·lules vives, interaccions moleculars a la interfície cèl·lula-substrat i dinàmica molecular in vitro.
- Mòdul TIRF integrat a l’Olympus FV1000
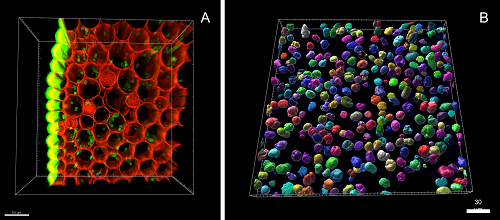
El processament d’imatges té com a objectiu millorar la qualitat de la imatge adquirida, ja sigui per a una presentació més òptima o per facilitar-ne l’anàlisi quantitativa posterior.
L’anàlisi i la quantificació d’imatges permeten extreure dades útils, sempre que aquestes hagin estat adquirides específicament amb aquesta finalitat.
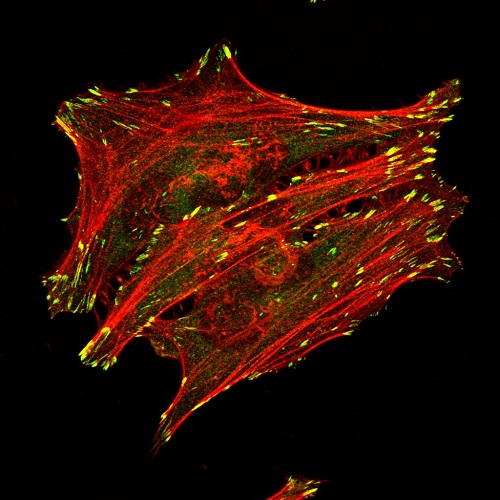
El tipus de preparació de mostres que realitza el personal tècnic comprèn des de la realització de marcatges directes (com ara traçadors cel·lulars, marcatges genèrics d'ADN, de proteïnes, etc) fins a immunodetecció d’antígens per a immunofluorescència.