Demuestran la potente actividad antimetastásica de cuerpos de inclusión bacterianos que liberan nanopartículas
10/02/2020
Investigadores del Institut de Recerca de l’Hospital de la Santa Creu i Sant Pau - IIB Sant Pau, de la Universitat Autònoma de Barcelona (UAB) y del Centro de Investigación Biomédica en Red (CIBER) han publicado un artículo en Advanced Materials, una de las revistas científicas internacionales más prestigiosas en el ámbito de la Nanomedicina y la Ciencia de los Materiales. El trabajo describe la generación por los propios investigadores, de una nueva forma farmacéutica de administración subcutánea y liberación sostenida de nanopartículas proteicas citotóxicas dirigidas, que eliminan selectivamente las células madre metastáticas, induciendo un potente efecto de prevención de la metástasis en un modelo de cáncer colorectal sin efectos adversos o tóxicos detectables.
El equipo de investigadores, formado por el equipo del Prof. Antonio Villaverde y la Dra. Esther Vázquez, del Instituto de Biotecnológia y Biomedicina de la UAB (IBB) y liderado por el Dr. Ramón Mangues, del Institut de Recerca de l’Hospital de la Santa Creu i Sant Pau - IIB Sant Pau, (que colaboran estrechamente desde hace más de una década) han creado cuerpos de inclusión de fibras amiloides y nanoestructuradas que cuando se administran por vía subcutánea, en ratones de laboratorio, son capaces de liberar nanopartículas citotóxicas solubles de manera continuada, portadoras de la exotoxina de Pseudomonas aeruginosa, lo que consigue mantener una concentración estable de esta nanomedicina en la sangre y en los tejidos.
Esta nueva forma farmacéutica de administración subcutánea para liberación sostenida permite administrar altas dosis de este nanofármaco, en intervalos prolongados (semanas en ratones y probablemente meses en humanos) sin toxicidad en el punto de inyección o en los tejidos normales, mientras genera un potente efecto antimetastático. El desarrollo del fármaco para su administración en humanos reduciría la necesidad de inyectar dosis frecuentes, por vía intravenosa, de los fármacos antitumorales citotóxicos actuales, lo que requiere hospitalización.
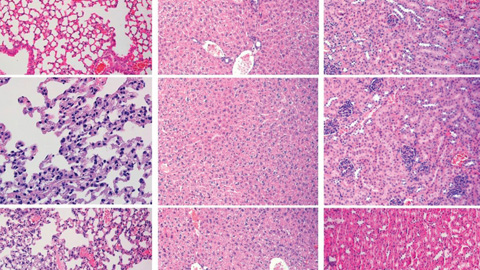
A parte de ser sistemas de liberación controlada, estos cuerpos de inclusión o nanopartículas incorporan un ligando que interacciona con el receptor (CXCR4), presente en niveles elevados en la membrana de las células madre metastásicas capaces de generar metástasis (CMM CXCR4+). Una vez administrada subcutáneamente esta nueva forma farmacéutica en ratones con cáncer colorrectal metastático, este ligando dirige cada nanopartícula liberada por esta estructura amieloide (agregados de proteínas de morfología fibrilar) hacia los tejidos tumorales, aumentando muy considerablemente su captación, para internalizar específicamente en las CMM CXCR4+ e inducir su destrucción selectiva.
Este efecto consigue una reducción notable del tamaño del tumor en el colon a la vez que bloquea el desarrollo de metástasis en los ganglios linfáticos, el pulmón, el hígado y el peritoneo, sin captación ni toxicidad apreciable en tejidos sanos (no tumorales). Esta terapia ofrece una respuesta a la urgente necesidad médica de inhibir el desarrollo de las metástasis, que representa la principal causa de muerte en pacientes con cáncer. Por otra parte, la destrucción selectiva de las células tumorales y metastáticas aumenta el índice terapéutico de esta nanomedicina, obteniendo un potente efecto antimetastático sin generar efectos adversos asociados, lo que la diferencia de la mayoría de los fármacos antitumorales usados actualmente, que producen efectos adversos frecuentemente severos.
Se estima que esta nueva estrategia terapéutica tendrá un elevado impacto clínico al reducir el requerimiento de su administración hospitalaria, que tienen la mayoría de fármacos antitumorales, y bloquear la diseminación metastática, dando respuesta a una necesidad clínica no cubierta. Por otra parte, es importante resaltar que esta nueva forma farmacéutica, que combina la liberación sostenida con el direccionamiento al receptor CXCR4, podría ser utilizada en el tratamiento de, como mínimo, 23 tipos de cáncer que también expresan altos niveles de este receptor en las células tumorales.
Enlace a la publicación:
https://onlinelibrary.wiley.com/doi/10.1002/adma.201907348