Notificación interna
¿Cómo presentar una solicitud de evaluación de actividades con agentes biológicos?
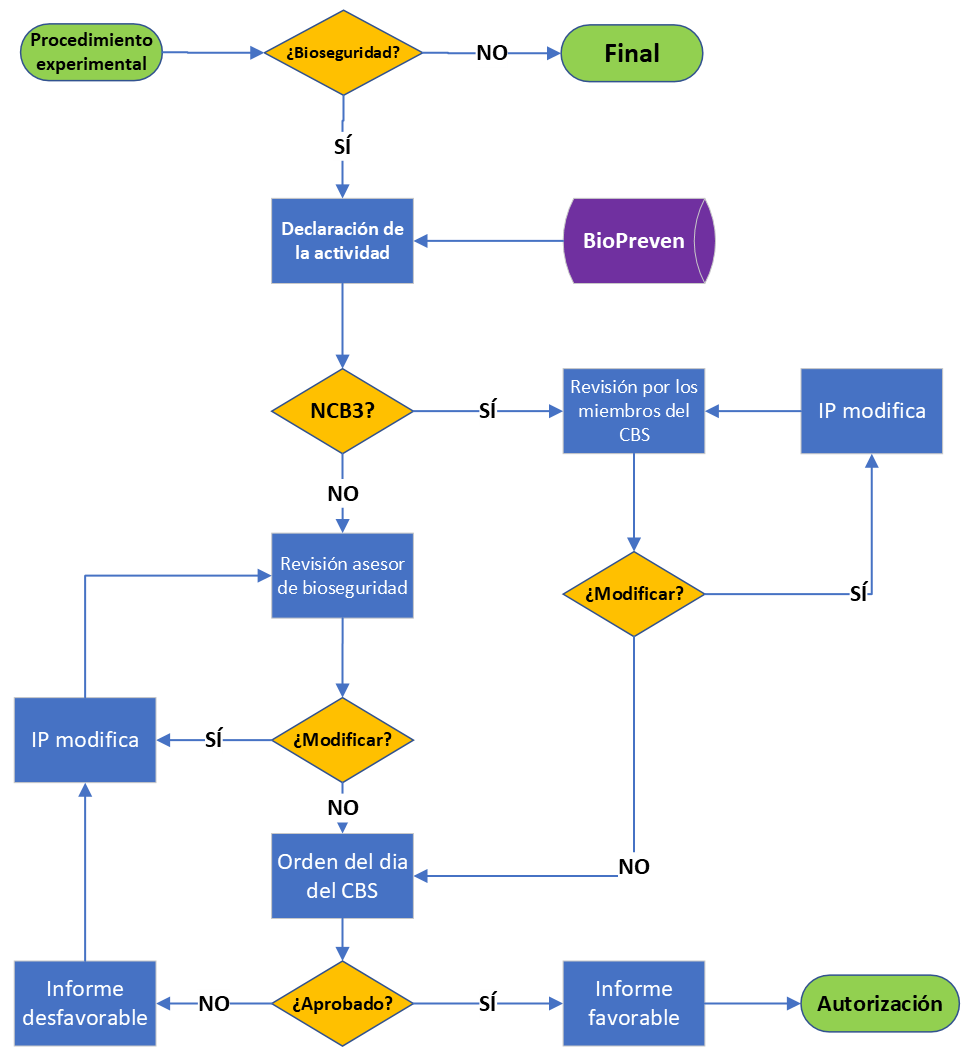
Siempre que se utilicen agentes biológicos en investigación o prácticas docentes, sea que estén modificados genéticamente o no, y que representen un riesgo para la salud o el medio ambiente, es necesario realizar una evaluación de riesgos y solicitar una revisión del CBS. La evaluación será realizada por el IP o el responsable docente y será notificada a través de la aplicación del CBS (BioPreven), hasta 15 días antes de la celebración de una reunión ordinaria (consultar el calendario). Este procedimiento se aplica también a la tramitación de renovaciones para procedimientos que han "caducado". Esta evaluación necesita estar documentada y disponible para la autoridad inspectora competente en materia de protección de la salud y del medioambiente.
- El uso de DNA/RNA recombinantes o sintéticos, incluyendo la creación de microorganismos, animales y vegetales modificados genéticamente.
- Las actividades deliberadas con patógenos humanos, animales o vegetales (bacterias, virus, hongos, protozoos, priones y parásitos), cultivos celulares o muestras que los contengan.
- La manipulación de cultivos de células humanas, órganos o tejidos no fijados de origen humano o primate no humano.
- El uso de animales o vegetales exóticos.
- El uso de biotoxinas con DL50 inferior a 100 µg/kg de peso corporal.
- La administración de agentes biológicos o productos biológicos experimentales en animales.
- La liberación voluntaria en el medio de OMG o de agentes biológicos que supongan una plaga para las plantas.
- Actividades deliberadas con AB, no OMG, de grupo 1 y que no se desarrollen en un animalario.
- Actividades con riesgo de exposición a AB de grupo 2, ya notificadas al CBS, y sin que exista una intención de cultivarlos (ej. producción de alimentos, trabajo agrario, asistencia sanitaria y veterinaria, necropsias, eliminación de residuos, etc.), excepto si el material tiene una elevada probabilidad de contener AB de los grupos 3/4.
- El almacenamiento, compra, envío, cultivo, transporte, destrucción, eliminación o utilización de OMG que sean comercializados y siempre que las condiciones de uso se ajusten a las de autorización de comercialización (ej. semillas y plantas transgénicas, medicamentos, animales transgénicos, etc.).
- El trabajo con biotoxinas de DL50 superior a 100 µg/kg de peso corporal.
- El transporte ferroviario, marítimo, fluvial, aéreo o por carretera de AB.
- Actividades con moléculas de DNA/RNA sintéticas o recombinantes que no se pueden replicar, generar nuevo DNA o integrarse en el DNA en ningún organismo o sistema biológico.
- La compra o transferencia de animales vertebrados transgénicos que deben mantenerse en un animalario de NCBA1.
- Actividades con OMG notificadas como de tipo 1 y no representen un cambio "significativo" del riesgo.
- Se realiza por primera vez.
- Hay clonación de oncogenes conocidos, DNA total o más de la mitad del genoma de AB de los grupos 3 o 4.
- Existe clonación en patógenos animales, humanos o vegetales de grupo 2 o superior.
- Existe producción a gran escala (más de 10 litros de cultivo).
- Existe transferencia deliberada de un gen de resistencia a antibiótico a un microorganismo que se sabe que de forma natural no podría adquirirla o bien si pone en peligro su uso en medicina, veterinaria o agricultura.
- Existe transferencia deliberada de DNA recombinante en humanos, animales o vegetales.
- Se trabaja con vectores virales de plantas, animales o sus derivados defectivos pero en presencia del virus auxiliar.
| Tipos | Ejemplo |
|---|---|
| Hacer parte de la actividad en un tipo de instalación distinta a la notificada y que supongan cambios en las medidas de control y contención. | La evaluación del riesgo determina la necesidad de implementar controles adicionales porque, por ejemplo, se pasa de pequeño a gran volumen de cultivo; porque se utilizarán animales, etc. |
| Uso de nuevos organismos en actividades de NCB3 | Introducir una nueva especie de grupo 3 en la actividad ya autorizada. |
| Uso de nuevos organismos o cepas de organismos con características inherentes distintas en actividades de tipo 1 o 2 | Se consideran características relevantes la vía de transmisión, patogenicidad, tropismo, disponibilidad de tratamiento o profilaxis. Esto incluiría pasar de cepa atenuada a virulenta (p. ej., modificación de cepas vacuna, o incompetentes para la replicación, o con distinto rango de huésped). |
| Uso de diferentes vectores, organismo receptor o insertados en la obtención de la OMG | Uso de insertos con propiedades más peligrosas, vectores con rango de huésped más amplio o con mutaciones que los hacen más virulentos, organismo receptor con mayor resistencia ambiental. |
| Cambios en el tipo de trabajo | Pasar de trabajar in vitro a in vivo; un cambio de modelo de estudio in vivo (ej. ratones por aves). |
| Cambios en las condiciones en las que previamente han sido autorizadas | Para actividades de utilización confinada de tipo 3 las autorizaciones pueden tener condiciones específicas (p. ej. derogación de las medidas de control). |
| Surge nueva información que hace cambiar las posibles consecuencias de una exposición | Nueva información proveniente de una publicación científica o de resultados preliminares y que afectan a los fundamentos en los que se basa la evaluación de riesgos (p. ej., nuevos datos sobre la función de virulencia atribuida a un gen determinado, la seguridad de una determinada técnica o características epidemiológicas de un organismo). |
¿Quién puede ser un Investigador Principal (IP) en un protocolo presentado al CBS?
El IP es un miembro del personal académico o investigador senior que tiene la responsabilidad de liderar el proyecto de investigación. El IP acepta la responsabilidad general de dirigir la investigación, supervisar las finanzas del proyecto, así como el cumplimiento de las normativas legales e internas.
¿Se consideran sinónimos un procedimiento experimental y un proyecto de investigación?
No, aunque pueden coincidir. Un proyecto puede tener uno o varios procedimientos experimentales (trabajo con animales, plantas, microorganismos, líneas celulares, artrópodos, muestras, a gran escala, etc.) con distintos niveles de contención biológica que requieren instalaciones y prácticas de trabajo claramente diferenciadas.
Si soy investigador de la UAB, ¿debo declarar al CBS de la UAB un procedimiento experimental que se realiza en un laboratorio que no está ubicado en el campus de la UAB?
En principio, corresponde al comité de bioseguridad del centro de acogida evaluar el procedimiento experimental propuesto. Sólo será necesario presentar la declaración si el centro está ubicado en el campus y tiene aprobada la solicitud de adscripción al CBS.
Si mi procedimiento experimental implica trabajar con E. coli K-12, plásmidos y Saccharomyces spp, ¿se requiere notificarlo al CBS?
Sí, depende del material genético que se esté manipulando para saber si el procedimiento experimental sólo necesita ser registrado o bien requiere una evaluación del CBS para su aprobación completa. Para la declaración de actividades con agentes biológicos hay que acceder a la aplicación del CBS (BioPreven).
¿Puedo enviar un resumen de la investigación por correo electrónico para que lo revisen y aprueben?
No. Hay un formulario de solicitud electrónica de notificación al CBS. Póngase en contacto con el Asesor de bioseguridad (tel. 8049) para obtener ayuda con el acceso a la aplicación del CBS (BioPreven).
Cuando caduca un procedimiento experimental aprobado por el CBS?
Los protocolos aprobados de NCB1 o NCB2 caducan después de 3 años, a partir de la fecha de aprobación inicial. En el caso concreto de procedimientos que requieren un NCB3 la vigencia es de un año.
¿Cómo puedo modificar mi notificación de actividad con AB, ya autorizada por el CBS de la UAB, si quiero reflejar una actualización de carácter más administrativo como altas/bajas de IP o personal implicado, parada de actividad, material biológico de mismo nivel de peligrosidad en el ya declarado, etc?
En estos casos, primero hay que asegurarse de que se ha actualizado el perfil del "Grupo de Investigación" en la aplicación y después comunicar los cambios al CBS mediante el e-formulario. El asesor de bioseguridad se encargará de modificar el procedimiento quedando registrada la modificación en el historial de su procedimiento experimental. Si la actualización solicitada supone un cambio “significativo” de la actividad deberá evaluarse y notificarse de nuevo al CBS.