Desvetllat un mecanisme que pot causar malalties genètiques
Les cèl·lules produeixen cada dia milers de noves proteïnes, que es renoven cada segon i que, obeint les ordres escrites en el nostre codi genètic, treballen per aconseguir el funcionament normal del nostre cos. Tanmateix, de vegades, les proteïnes poden sofrir una mutació genètica que pot provocar canvis en la seva composició, impedint que assoleixin la seva forma funcional i realitzin les activitats que tenen assignades. Això acaba donant lloc, en molts casos, a la formació de macromolècules d'agregats tòxics -les fibres amiloides-, que bloquegen el sistema de control de qualitat proteica del nostre cos i acaben provocant la mort cel·lular.
L'agregació proteica i el plegament incorrecte de les proteïnes es troba en l'origen de moltes malalties anomenades conformacionals, que poden ser d'origen genètic o d'aparició espontània. Les proteïnes que hi estan implicades poden tenir una forma desestructurada o lineal, desplegada, com en l'Alzheimer, el Párkinson o la Diabetis Tipus II, o globular, mostrant una estructura tridimensional i replegades sobre elles mateixes. Les primeres han estat àmpliament caracteritzades pels investigadors i se'n coneix el procés pel qual es despleguen, deixant al descobert les regions perilloses amb tendència a agregar i esdevenint tòxiques. De les globulars, en canvi, que se sap que estan associades a greus malalties hepàtiques, cardíaques, renals o neurològiques, no és coneixia de manera clara com podien agregar-se, tot i trobar-se ben plegades dins del cos humà.
Mitjançant anàlisi computacional, els investigadors Salvador Ventura i Virgínia Castillo han descobert que les proteïnes globulars implicades en malalties conformacionals genètiques, en condicions de no malaltia, es troben associades en parelles a d'altres proteïnes o en complexos de més subunitats, del tal manera que el que fa una de les proteïnes és tapar la regió amb tendència a agregar de l'altra, evitant el desencadenament d'aquest procés. Així, aquestes regions romanen ocultes en l'interior de la seva estructura essent inofensives per a l'organisme mentre les dues proteïnes estan encaixades. Els investigadors han trobat que mutacions genètiques produïdes en la regió d'interacció de la parella de proteïnes evita la seva associació, deixant al descobert les regions susceptibles d'agregar i afavorint la seva toxicitat. Això explicaria, segons els investigadors, perquè si hi ha dues persones amb les mateixes proteïnes globulars i amb les mateixes regions perilloses, la persona que pateix la mutació pateix la malaltia i l'altra no.
Les conclusions obtingudes han portat als investigadors a contemplar la possibilitat que la dissociació de proteïnes sigui un mecanisme general, que no només afecti proteïnes globulars de les quals es coneix l'estructura, sinó també altres encara no caracteritzades que puguin estar darrera de malalties la causa de les quals encara no es coneix.
Com a possibles estratègies per evitar la dissociació de proteïnes, els autors proposen d'introduir-hi mutacions genètiques per tal d'enfortir la seva associació i el desenvolupament de molècules específiques que bloquegin les regions perilloses de les proteïnes ja dissociades.
Els resultats de l'estudi dels investigadors de la UAB coincideix pràcticament en el temps amb els que han obtingut investigadors de la Universitat de Cambridge, publicats a "Proceedings of the National Academy of Sciences".
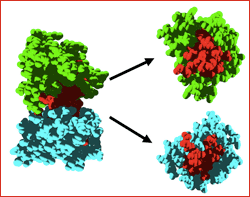
En un futur, els investigadors de la UAB planegen estendre la seva anàlisi computacional al conjunt de totes les proteïnes humanes per a les quals es disposa d'una estructura tridimensional. Esperen així trobar les proteïnes responsables de diferents malalties genètiques, l'origen de les quals és encara desconegut, i poder suggerir un conjunt de noves dianes terapèutiques per a aquests desordres. Imatge: Una de les parelles de proteïnes globulars estudiada. La regió perillosa d'ambdues proteïnes (regió d'interacció), en vermell, resta oculta i inofensiva mentre romanen unides. La mutació genètica provoca la seva separació, deixant al descobert les regions susceptibles d'agregar i afavorint la seva toxicitat.
Referències
"Amyloidogenic Regions and Interaction Surfaces Overlap in Globular Proteins Related to Conformational Diseases". Castillo V, Ventura S. PLoS Comput Biol. Volum 5, Issue 8, August 2009.


