Un nou estudi demostra que els conills no són resistents a la infecció per prions
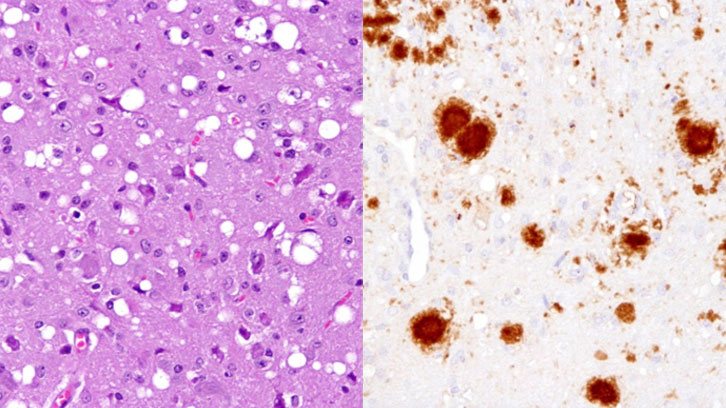
Una investigació coordinada pel centre d’investigació cooperativa en biociències CIC bioGUNE ha demostrat in vivo que els conills no són resistents a les encefalopaties espongiformes, malalties neurodegeneratives causades per prions, encara que sí semblen mostrar una resistència superior a altres mamífers. L’estudi, liderat pel Dr. Joaquín Castilla, s’ha realitzat a les instal·lacions de bioseguretat de nivell 3 de l’IRTA-CReSA sota la direcció del Dr. Enric Vidal i ha comptat amb la col·laboració de la Dra. Belen Pintado del CNB. El projecte ha estat finançat pel MINECO (AGL2008-05296-C02). L’estudi s’ha prolongat durant quatre anys i ha estat recentment publicat a la prestigiosa revista PLoS Pathogens.
Els prions són una versió anòmala i infecciosa de la proteïna PrP, que en el seu estat benigne es troba en les neurones de tots els mamífers. Quan un prió –paraula derivada de “partícula proteica infecciosa”–s’introdueix en un organisme sa, actua sobre la forma normal de la proteïna, causa el seu mal plegament i la converteix en un nou prió. L’acumulació d’aquestes proteïnes anòmales i infeccioses activa la mort neuronal i desencadena les denominades encefalopaties espongiformes, malalties neurodegeneratives que no disposen de cura ni tractament i reben aquest nom per l’aspecte foradat que presenta l’encèfal dels exemplars malalts si s’observa al microscopi. Una de les més conegudes és la que afecta els bovins, anomenada popularment com el mal de les vaques boges.
Per dur a terme la investigació, s’ha dissenyat, al Centre Nacional de Biotecnologia CNB-CSIC, una línia de ratolins transgènics als quals se’ls va substituir el gen que codifica la proteïna PrP de ratolí per la corresponent al conill. “Es tracta de models més petits que els lepòrids, però que representen molt bé al conill real i el seu cost més econòmic ens permeten dur a terme la investigació amb un nombre molt més significatiu d’exemplars”.
Els ratolins transgènics van ser posteriorment inoculats, a la unitat de biocontenció de nivell 3 del CReSA, amb prions circulants reals d’ovella, vaca, ratolí i cérvol i els investigadors van observar que els animals desenvolupaven una encefalopatia espongiforme amb els prions aïllats de vaca, ratolí i ovella. No obstant això, no es va produir infecció amb el prió procedent del cérvol. “Durant 40 anys es pensava que la proteïna del conill no es podia mal plegar. Nogensmenys, això no és així i aquest és el primer fet que hem demostrat. No hi ha res en la proteïna del conill que la faci resistent al mal plegament”.
El 2012, l’equip dirigit per Castilla va posar la primera pedra en confirmar la infecció de conills utilitzant un prió de síntesi dissenyat al laboratori, però l’estudi actual suposa la verificació in vivo, amb prions reals que es troben espècies ramaderes. “Aquestes conclusions s’han de tenir en compte en l’alimentació dels conills, especialment si es fan servir pinsos que continguin proteïna animal”.
Diferents estudis, conclusions idèntiques
A més d’aquests resultats, es publica al mateix número de la revista un estudi que científics de l’Institut de Recerca Agronòmica de França (INRA) han portat a terme directament amb conills transgènics als quals se’ls va introduir el gen de la proteïna PrP d’origen oví. Posteriorment, els investigadors els van inocular prions ovins i van observar que passats entre 6 i 8 mesos els conills emmalaltien d’una encefalopatia espongiforme, de manera que aquest estudi també conclou que no hi ha cap element a la resta del genoma dels conills que els faci resistents.
Per què és tan difícil tornar boig al conill?
Durant 4 dècades s’ha cregut que els lepòrids eren resistents a la infecció per prions, basant-se en la inexistència d’encefalopaties espongiformes en conills. Les investigacions més recents han refutat aquesta teoria i de moment no han estat capaces de desvetllar les causes per les quals els conills semblen ser més resistents a les malalties priòniques que la resta de mamífers. L’absència de casos de conills amb aquesta malaltia podria residir en el fet que els lepòrids no han estat tant exposats a pinsos derivats de proteïna animal infectada com ha succeït amb altres espècies. Una altra de les claus rau en l’edat de l’animal. Les encefalopaties espongiformes presenten un temps d’incubació generalment prolongat i els conills són sacrificats en edats molt primerenques.
Centre de Recerca en Sanitat Animal (CReSA)
IRTA
Referències
Vidal, E.; Fernández-Borges, N.; Pintado, B.; Eraña, H.; Ordóñez, M.; Márquez, M. et al. Transgenic Mouse Bioassay: Evidence That Rabbits Are Susceptible to a Variety of Prion Isolates. PLoS Pathogens. 2015, vol. 11, num. 8, e1004977. doi: 10.1371/journal.ppat.1004977.


