Alternatives als antibiòtics: estudi comparatiu entre ribonucleases
En el nostre grup de recerca estem estudiant les ribonucleases antimicrobianes humanes. Aquestes proteïnes del sistema immunitari innat presenten activitat antipatògena i pertanyen a una de les primeres línies de defensa del cos contra les infeccions. Les proteïnes i pèptids antimicrobians són alliberats com a resposta als processos d’infecció i d’inflamació i actuen provocant la mort dels microorganismes responsables. Alhora, poden modular part de l’acció de conjunt del sistema immunitari per tal de controlar l’extensió del patògen i regular els processos de sepsis.
L’ús generalitzat dels antibiòtics i, a vegades, el seu abús o mal ús ha generat l’aparició de soques de microorganismes resistents a aquests fàrmacs que, en alguns ambients, com en el cas dels hospitals, poden ser especialment problemàtics.
L’augment preocupant de les resistències a determinats tipus d’antibiòtics ha portat als laboratoris de recerca i a les empreses farmacèutiques a desenvolupar nous fàrmacs amb una activitat similar a la dels antibiòtics, amb l’esperança de minimitzar el risc de resistències.
En aquest punt, els pèptids antimicrobians es presenten com una possible alternativa als antibiòtics convencionals. Aquests pèptids presenten un ampli espectre d’activitat, una baixa toxicitat per al cos humà i una menor susceptibilitat a generar resistències.
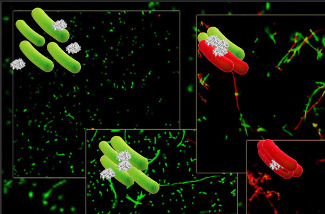
Una de les activitats menys estudiades d’aquestes proteïnes i pèptids és la seva capacitat d’aglutinar els microorganismes, principalment bacteris. Aquest efecte consisteix en agregar a nivell local una gran quantitat de microorganismes, fet que permet al cos humà localitzar millor el focus d’infecció i utilitzar el seu armament molecular de forma molt més eficaç.
Nosaltres hem estudiat dues ribonucleases antimicrobianes que malgrat ser molt semblants en la seva estructura presenten efectes ben diferents. Aquestes dues proteïnes pertanyen a la família d’enzims de la RNasa A, una de les primeres proteïnes de les que es va conèixer la seva estructura i activitat catalítica als estudis pioners dels anys 60. Durant els últims anys s’ha descrit que alguns membres de la família amb activitat citotòxica poden participar en el sistema immunitari innat i contribuir a la lluita contra les infeccions, tant pel que fa a bacteris, virus o paràsits.
Per a poder descobrir com funcionen aquestes dues proteïnes hem emprat una estratègia múltiple, amb eines de predicció informàtica (Torrent et al, BMC Bioinformatics 10, 373, 2009), models de membrana sintètica (Torrent et al., BBA, 1788, 1116, 2009) i disseny de pèptids derivats (Torrent et al., Biochem J 421, 425, 2009). En aquest últim treball els sistemes biofísics senzills s’han completat amb la visualització en viu per microscòpia electrònica i confocal del seu comportament en cultius bacterians.
Tot i la semblança en la seva seqüència i estructura, les dues ribonucleases presenten un mecanisme d’acció antimicrobiana molt diferent i només una d’elles, la ribonucleasa 3, també anomenada proteïna catiònica d’eosinòfils (ECP), presenta efectes aglutinants. En aquest estudi s’ha proposat que aquesta activitat podria ser estar dirigida per una zona hidrofòbica exposada i una regió d’unió a lipopolisacàrids, ambdues ubicades a l’extrem N-terminal de la proteïna.
La ribonucleasa derivada de pell, o RNasa 7, l’altra proteïna estudiada, no presenta ni efectes d’aglutinació ni cap zona hidrofòbica exposada. En canvi, aquesta proteïna té una alta activitat lítica tant en soques bacterianes gram-positiu com gram-negatiu.
L’existència de dues proteïnes homòlogues amb mecanismes d’acció diferenciats podria ajudar a entendre quins són els determinants que dirigeixen un o altre procés i, per tant, aprofundir en el disseny de pèptids antimicrobians capaços de combatre les infeccions per a microorganismes resistents als antibiòtics.
Referències
"Comparison of human RNase 3 and RNase 7 bactericidal action at the Gram-negative and Gram-positive bacterial cell wall". Torrent, M; Badia, M; Moussaoui, M; Sanchez, D; Nogues, MV; Boix, E. FEBS JOURNAL, 277 (7): 1713-1725 APR 2010.


