L'especificitat de la SUMO proteasa humana, desxifrada
El grup del Doctor David Reverter Cendrós, investigador de l'IBB, ha dut a terme la caracterització estructural de la proteasa humana SENP5 amb l'objectiu d'identificar els residus clau per a la discriminació i l'especificitat d’aquesta respecte als diferents tipus de SUMO.
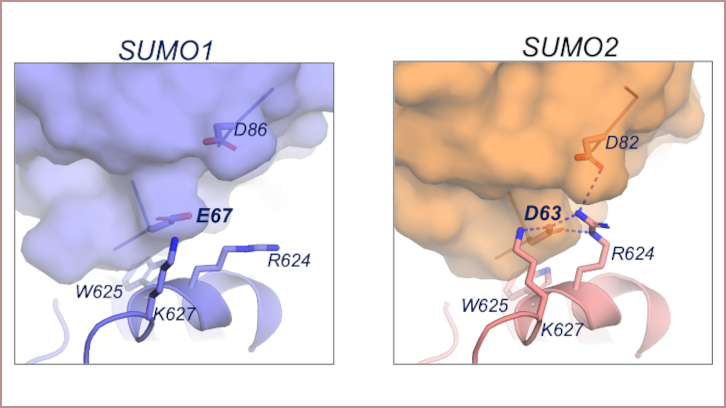
Les modificacions posttraduccionals són canvis en les proteïnes que exerceixen un paper fonamental en la regulació cel·lular, ja que poden alterar-ne l’activitat biològica i influir en diversos processos fisiològics. N’existeixen de molts tipus, entre els quals es troba la SUMOilació, un mecanisme en què la proteïna SUMO (Small Ubiquitin-like MOdifier) s'uneix covalentment a altres proteïnes i en modula les funcions. És un procés complex amb un gran nombre de proteïnes implicades: tant les necessàries per a l'activació de SUMO com les que són la diana de la modificació. Concretament, hi destaquen les SUMO proteases, que són les encarregades d'activar la molècula de SUMO, així com de processar i eliminar la seva unió de les proteïnes diana. El grup del Doctor David Reverter Cendrós, investigador de l'IBB, ha dut a terme la caracterització estructural de la proteasa humana SENP5 amb l'objectiu d'identificar els residus clau per a la discriminació i l'especificitat d’aquesta respecte als diferents tipus de SUMO. En aquest article presenten l'estructura tridimensional de SENP5 en complex amb diferents tipus de SUMO. Els resultats de l'anàlisi dels diferents complexos revelen una regió amb càrrega positiva que està directament implicada en la preferència de SENP5 per SUMO2. Gràcies a la caracterització estructural han pogut definir els contactes clau de SENP5 amb SUMO2. Això obre el camí a la investigació i el disseny de possibles inhibidors específics per a aquesta proteasa.