Respuesta celular a un mal plegamiento de proteínas
El mal plegamiento y la agregación de proteínas están asociados a numerosas enfermedades degenerativas como la diabetes-tipo-II o el Alzheimer. Sin embargo, las proteínas propensas a agregar parecen estar conservadas en todos los reinos de la vida. De hecho, hay un número creciente de ejemplos en los que las células utilizan los agregados de proteínas para propósitos funcionales, como el ordenamiento de la melanina en la piel o el almacenamiento de memoria. En consecuencia, durante su evolución, las células han tenido que desarrollar diferentes estrategias para tolerar y controlar el proceso de agregación.
Una de las principales líneas de investigación de nuestro grupo es el estudio del mal plegamiento y la agregación de proteínas relacionadas con la enfermedad. Estudiamos este fenómeno desde un punto de vista biofísico, para conocer las propiedades de las proteínas que están involucradas en este suceso, y también utilizando modelos vivos, para entender su relación con las enfermedades y las funciones celulares.
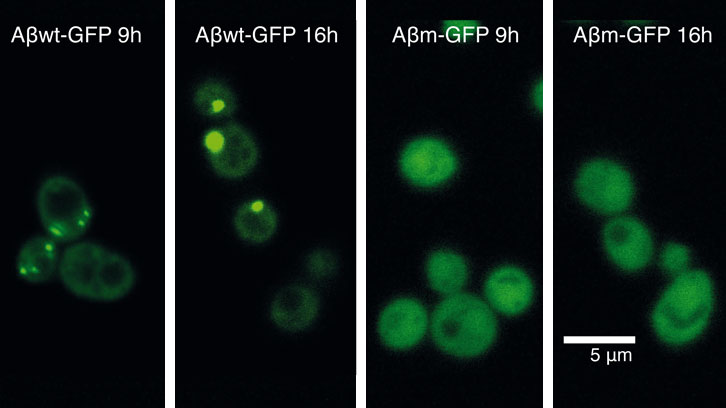
En un primer intento por descubrir cómo las células responden contra el mal plegamiento de las proteínas, expresamos 20 péptidos, fusionados con la proteína verde fluorescente GFP y que cubrían un rango continuo de propensiones a agregar. Estos péptidos los diseñamos basándonos en la secuencia del péptido-β-amiloide (Aβ42) (asociado a la enfermedad de Alzheimer) y los expresamos en células de levadura. Curiosamente, aunque la mayor parte de estos péptidos son altamente insolubles, sólo algunos de ellos son reclutados en agregados intracelulares (o cuerpos de inclusión). Con este sistema pudimos identificar un umbral de propensión a la agregación por encima del que la célula comienza a acumular activamente una proteína en agregados.
En el trabajo que comunicamos hoy, hemos utilizado dos péptidos de esta colección, que se encuentran a ambos lados del umbral de agregación, para descifrar por qué las proteínas forman o no agregados intracelulares. En concreto, hemos caracterizado el impacto que la expresión de estas dos proteínas tiene sobre el bienestar celular.
|
|
Figura 2: Una respuesta contra las proteínas desplegadas: dos estrategias para el control de los efectos tóxicos. El modelo muestra los diferentes costes y beneficios de la acumulación de una proteína mal plegada en agregados. Específicamente, este diagrama muestra dos proteínas, mayoritariamente insolubles, pero situadas a ambos lados de un umbral de agregación por encima del cual la célula acumula activamente una proteína en agregados [11] (a). Este proceso podría ofrecer beneficios pero también es energéticamente costoso (coste). Bajo el umbral, la proteína permanece difusa por el citoplasma (b). Eso podría favorecer la formación de interacciones nocivas que podrían iniciar una cascada de mal plegamiento y de estrés oxidativo. ROS, especies reactivas al oxígeno. |
Institut de Biotecnologia i Biomedicina (IBB-UAB)
Referencias
Sanchez de Groot, N.; Gomes, R. A.; Villar-Pique, A.; Babu, M. M.; Coelho, A. V.; Ventura, S. Proteome response at the edge of protein aggregation. Open Biology. 2015, vol. 5, num. 2, p. 140221. doi: 10.1098/rsob.140221.
Villar-Pique, A.; Ventura, S. Protein aggregation propensity is a crucial determinant of intracellular inclusion formation and quality control degradation. Biochimica et Biophysica Acta. 2013, vol. 1833, num. 12, p. 2714-2724. doi: 10. 1016/j.bbamcr.2013.06.023.
Sanchez de Groot, N.; Torrent, M.; Villar-Pique, A.; Lang, B.; Ventura, S.; Gsponer, J.; Babu, M. M. Evolutionary selection for protein aggregation. Biochemical Society transactions. 2012, vol. 40, num. 5, p. 1032-1037. doi: 10. 1042/BST20120160.
De Groot, N. S.; Aviles, F. X.; Vendrell, J.; Ventura, S. Mutagenesis of the central hydrophobic cluster in Abeta42 Alzheimer’s peptide. Side-chain properties correlate with aggregation propensities. FEBS Journal. 2006, vol. 273, num. 3, p. 658-668. doi: 10.1111/j.1742-4658.2005.05102.x.


