Ref2, una subunidad proteica implicada en el crecimiento celular
Diversas características de las proteínas celulares, que van desde la actividad enzimática, a la localización intracelular o la capacidad de interaccionar con otras moléculas, entre otras, son reguladas mediante la adición o eliminación de grupos fosfato de algunos de los aminoácidos que las componen. El estado de fosforilación de una proteína es el resultado del balance de las actividades entre las proteínas fosforiladoras (quinasas) y desfosforiladoras (fosfatasas). La desregulación en cualquiera de estas actividades, presentes en todos los organismos eucariotas, puede desencadenar importantes alteraciones en la fisiología celular, pudiendo dar lugar a graves enfermedades. Uno de los mecanismos que controlan a las proteínas quinasas y fosfatasas es el de su unión a otras proteínas, denominadas subunidades reguladoras, que modulan su actividad, especificidad de substrato, localización, etc.
En el laboratorio estamos interesados en la regulación de Glc7, una proteína fosfatasa de tipo 1 de la levadura S. cerevisiae, implicada en múltiples e importantes funciones esenciales para la viabilidad celular, siendo el mantenimiento de la homeóstasis iónica uno de ellos. Es, precisamente, esta diversidad de funciones de Glc7 lo que hace que disponga de múltiples subunidades reguladoras (al menos 18), aunque son más de cien las proteínas con las que se ha detectado, por uno u otro método, que son capaces de unirse a esta fosfatasa. La mayor parte de las subunidades reguladoras de Glc7 poseen una secuencia aminoacídica característica [(R/K)(V/I)X(F/W)] mediante la cual tiene lugar la unión a la fosfatasa. Con el fin de identificar las funciones celulares en las que se encuentra implicada cada subunidad reguladora de Glc7, estamos estudiando los efectos que la falta de cada una de éstas provoca.
De los resultados preliminares nos llamaron la atención los concernientes a Ref2, una subunidad exclusivamente implicada en varios procesos relacionados con el procesamiento y maduración de diversos tipos de RNA. Nuestros resultados indicaban que las células carentes de Ref2 presentaban un crecimiento muy lento tanto en presencia de cationes de calcio (CaCl2), sodio (NaCl) o litio (LiCl) como a pH alcalino. Estas sensibilidades resultan sintomáticas de defectos en la homeóstasis iónica. De hecho, las células carentes de Ref2 presentan un crecimiento más lento que las células wild type en condiciones limitantes de potasio, así como una mayor sensibilidad a diversos cationes orgánicos tóxicos, como el TMA (tetrametilamonio), la higromicina B o la espermina. Hechos, todos ellos, no atribuibles a un defecto en el procesamiento del RNA.
Además, los defectos descritos, consecuencia de la falta de la proteína Ref2, son comparables a aquellos observados en células que expresan una proteína Ref2 idéntica a la nativa exceptuando la mutación de un aminoácido del motivo (R/K)(V/I)X(F/W), lo cual le impide su interacción (y regulación) con Glc7.
La hipersensibilidad al litio se debía a un defecto en la destoxificación del catión, proceso realizado por la proteína ATPasa Ena1. Este hecho puede ser explicado, al menos en parte, por el hecho de que en ausencia de Ref2, la expresión del gen ENA1 no se induce como lo haría en las células wild type en presencia de litio y otros estreses. Por tanto, implicamos a Ref2 en la regulación de la expresión de ENA1.
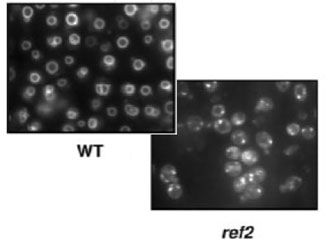
Determinamos que la alta sensibilidad a calcio es explicada por una mayor actividad de una proteína fosfatasa dependiente de calcio, debido a una concentración anormalmente elevada de calcio intracelular en los mutantes ref2. Un compartimento celular importante en la homeóstasis del calcio es la vacuola, cuya disfunción va frecuentemente acompañada de defectos en su morfología. La tinción de la membrana vacuolar de las células ref2 manifestó que la falta de esta subunidad reguladora provoca importantes defectos en la morfología vacuolar (ver figura).
Además, hemos demostrado que en células portadoras de diversas mutaciones en las que se produce un deficiente procesamiento del RNA, la homeóstasis catiónica no se ve en absoluto afectada.
Todo ello nos permite determinar que la proteína Ref2, mediante su unión a la fosfatasa Glc7, interviene en funciones relacionadas con el mantenimiento de la homeóstasis iónica para las cuales no se había identificado aún la subunidad reguladora responsable. Por tanto, Ref2 representa un ejemplo de subunidad reguladora de Glc7 con diversas funciones celulares.
Referencias
"Ref2, a regulatory subunit of the yeast protein phosphatase 1, is a novel component of cation homoeostasis". Jofre FERRER-DALMAU, Asier GONZÁLEZ, María PLATARA, Clara NAVARRETE, José L. MARTÍNEZ, Lina BARRETO, José RAMOS, Joaquín ARIÑO, Antonio CASAMAYOR. Biochem. J. (2010) 426, 355–364.


