Nuevos descubrimientos en la formación de moléculas
En la experimentación química, continuamente se trabaja en la combinación de diferentes moléculas. Es fundamental poder ajustar al máximo el resultado de estas asociaciones para obtener el resultado esperado. Investigadores del Departamento de Química de la UAB han estudiado cómo se consigue un alto nivel de regioselectividad, es decir, cómo obtener mayoritariamente un regioisómero (un tipo de molécula) de los dos posibles cuando se combina un pirazol (un compuesto cíclico aromático) con un grupo alquilo (cadena de carbono e hidrógeno).
El pirazol es un compuesto cíclico aromático que consiste en un anillo de cinco miembros con dos átomos de nitrógeno en las posiciones 1 y 2. Su aromaticidad se debe a la presencia de un sistema cíclico de cinco orbitales p ininterrumpidos el cual contiene seis electrones. El nitrógeno en posición 1 es de tipo azole ya que aporta un par de electrones no enlazantes al anillo aromático y forma un enlace N-H con un protón acídico dando un cierto carácter ácido. En cambio, el nitrógeno en posición 2 es de tipo azina teniendo el par de electrones fuera del heterociclo de manera que permite al pirazol actuar como base y como nucleófilo (especie capaz de unirse a otras moléculas donando un par de electrones) (Figura 1).
El pirazol puede estar sustituido en diferentes posiciones del anillo, en este trabajo los pirazoles están sustituidos en las posiciones 3 y 5 que modulan la nucleofilidad del nitrógeno en posición 2 y el carácter ácido del protón en posición 1, así como la accesibilidad estérica (accesibilidad en el espacio) (i, ii). Existe también la posibilidad de sustituir la posición 1, en nuestro caso con un grupo alquilo (cadena que únicamente contiene carbono e hidrógeno). Según si unimos el grupo alquilo al N(1) o al N(2) se obtendrán dos especies diferentes, las cuales no se pueden ínter convertir por ningún equilibrio. Este tipo de moléculas se llaman isómeros de posición o regioisómeros, los cuales presentan la misma fórmula molecular pero propiedades químicas y físicas diferentes (iii).
Se entiende por regioselectividad de una reacción cuando por una ruta sintética se obtiene un regioisómero mayoritariamente; esto dependerá de las condiciones de trabajo así como de los reactivos utilizados. Es importante conseguir reacciones regioselectivas, ya que de esta manera se aumenta el rendimiento en la obtención del producto deseado, además de no necesitar ninguna técnica de separación.
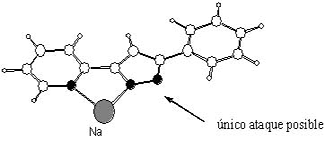
Así, la reacción estudiada en este trabajo es la obtención de nuevos compuestos N-alquilo-3,5-pirazol a partir de un pirazol 3,5-sustituido y el haloalcano apropiado. (Figura 1). El proceso más eficiente encontrado corresponde a la utilización de hidruro de sodio como base (NaH), el yodoalcano correspondiente y como disolvente el tetrahidrofurano. Esta reacción puede dar lugar a la formación de dos regioisómeros. Experimentalmente se observa que para la reacción del 3-fenil-5-metil-1H-pirazol se forman los dos regioisómeros en una proporción 60:40. Cuando una de las posiciones del pirazol (3 o 5) es una piridina (anillo aromático de seis miembros con un N), se puede obtener una gran regioselectividad (98:2). Además del trabajo realizado en el laboratorio de síntesis se han llevado a cabo una serie de cálculos teóricos (buscando estados de menor energía que justifiquen dicha regioselectividad) (iv) esto nos ha llevado a afirmar que la causa de esta regioselectividad es la formación de un quelato (complejo entre el catión Na+, el nitrógeno de la piridina y uno de los nitrógenos del pirazol), que impide el ataque de esa posición por parte del haloalcano llevando a la obtención mayoritaria de uno de los regioisómeros.(Figura 2).
Figura 1

REGIOISÓMEROS
R1 = metilo, trifluorometilo o fenilo
X = C o N
R2 = etilo, octilo
Figura 2

Referències
i S. Trofimenko, Prog. Inorg. Chem. 1986, 34, 115.
ii R. Mukerjee, Coord. Chem. Rev. 2000, 203, 151.
iii V. Montoya, J. Pons, X. Solans, M. Font-Bardia, J. Ros,
Inorg. Chim. Acta 2005, 358, 2763.
iv J. M. Gonzales, C. Pak, R. S. Cox, W. D. Allen, H. F. Schaefer, A. G. Császár,
G. Tarczay, Chem. Eur. J. 2003, 9, 2173 and references therein.
Referencias
Artículo: "Regioselective formation of N-alkyl-3,5-pyrazole derived ligands. A synthetic and computational study". Montoya, V; Pons, J; Branchadell, V; Ros, J. TETRAHEDRON, 61 (52): 12377-12385 DEC 26 2005


