La especificidad de la SUMO proteasa humana, descifrada
La SUMOilación es un tipo de modificación postraduccional en la que la proteína SUMO se une covalentemente a otras proteínas y modula sus funciones. Es un proceso complejo que involucra muchas proteínas, como las proteasas SUMO, que activan la molécula SUMO. Este estudio analiza los residuos involucrados en la discriminación y especificidad de la proteasa humana SENP5 respecto a diferentes tipos de SUMO.
Las modificaciones postraduccionales son cambios en las proteínas que ejercen un papel fundamental en la regulación celular, ya que pueden alterar su actividad biológica e influir en diversos procesos fisiológicos.
Existen muchos tipos, entre los cuales se encuentra la SUMOilación, un mecanismo en el que la proteína SUMO (Small Ubiquitin-like MOdifier) se une covalentemente a otras proteínas y modula sus funciones. Es un proceso complejo con un gran número de proteínas implicadas: tanto las necesarias para la activación de SUMO como las que son la diana de la modificación. Concretamente, destacan las SUMO proteasas, que se encargan de activar la molécula de SUMO, así como de procesar y eliminar su unión de las proteínas diana.
Nuestro grupo de investigación ha llevado a cabo la caracterización estructural de la proteasa humana SENP5 con el objetivo de identificar los residuos clave para la discriminación y la especificidad de esta respecto a los distintos tipos de SUMO.
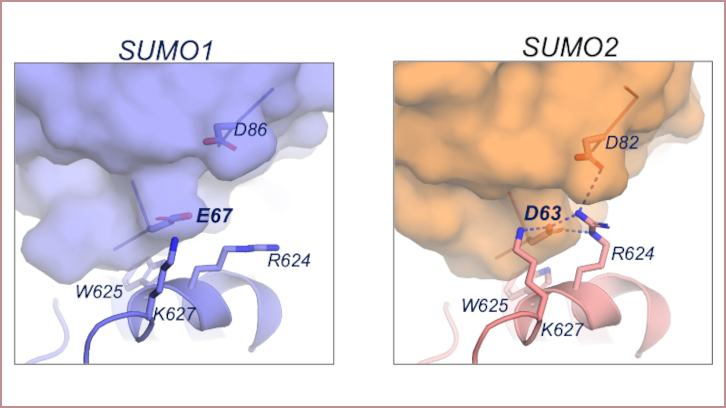
En este artículo presentamos la estructura tridimensional de SENP5 en complejo con distintos tipos de SUMO. Los resultados del análisis de los distintos complejos revelan una región con carga positiva que está directamente implicada con la preferencia de SENP5 por SUMO2. Gracias a la caracterización estructural hemos podido definir los contactos clave de SENP5 con SUMO2. Esto abre el camino a la investigación y el diseño de posibles inhibidores específicos para esta proteasa.
David Reverter
Departamento de Bioquímica y Biología Molecular
Institut de Biotecnologia i Biomedicina
Universitat Autònoma de Barcelona
Monique Mulder
Universiteit Leiden
Virginia Amador
Consorci Institut D'Investigacions Biomediques August Pi I Sunyer
Referencias
Sánchez-Alba, L.; Ying, L.; Maletic, M.D. et al. (2025). Structural basis for the human SENP5’s SUMO isoform discrimination. Nature Communications 16, 4764. https://doi.org/10.1038/s41467-025-60029-4


