Identificadas nuevas propiedades de una enzima del sistema de defensa humano
La ribonucleasa es una enzima que secretan los leucocitos cuando se presenta una infección, ya sea por virus o por bacterias. En un estudio reciente, el grupo de investigación liderado por Ester Boix, del Departamento de Bioquímica y Biología Molecular, ha identificado nuevas propiedades inmunomoduladoras de esta molécula, que se suman a sus ya conocidas actividades catalíticas y antimicrobianas. El mecanismo de acción de este comportamiento multifacético, empleado de manera diferente según el tipo de infección, abre las puertas al diseño de nuevos agentes terapéuticos.
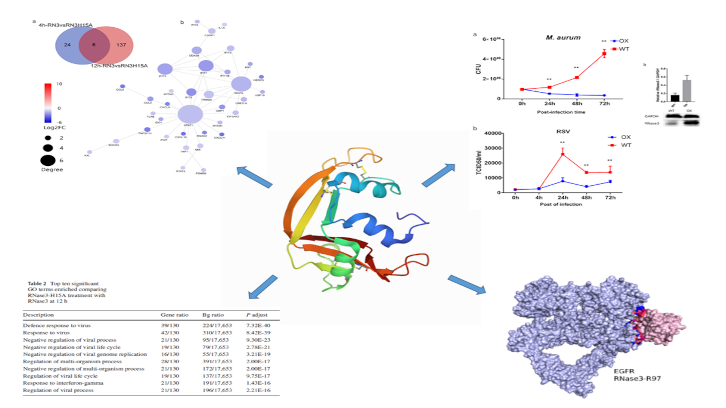
En este estudio, realizado por el grupo de investigación de la UAB liderado por la Dra. Ester Boix hemos identificado nuevas propiedades immunomoduladoras de una pequeña proteína con actividad ribonucleasa del sistema de defensa humano. Hemos observado cómo la RNasa 3 humana es secretada por los macrófagos durante los procesos infecciosos. Mediante un estudio comparativo por transcriptómica de macrófagos expuestos a la proteína nativa y su variante defectiva en actividad ribonucleasa, se han podido identificar nuevas actividades señalizadoras tanto dependientes como independientes del mecanismo de catálisis: una respuesta inicial pro-inflamatoria no asociada a la actividad catalítica, seguida de una activación tardía directamente dependiente de la actividad de degradación del RNA.
Curiosamente, este comportamiento multifacético de la RNasa 3 es empleado de manera diferencial en función del tipo de infección. Así, se ha podido comprobar cómo la sobre-expresión de la proteína protege a los macrófagos tanto frente a una infección bacteriana como vírica, pero el perfil de respuesta inmune no es el mismo.
Durante la respuesta inicial pro-inflamatoria la RNasa 3 actúa como una molécula señalizadora y activa directamente el receptor de crecimiento epidérmico EGFR. Hemos podido comprobar la interacción directa de la proteína con el receptor mediante la utilización de un anticuerpo específico que bloquea el dominio extracelular del receptor. Además, estudios de modelado estructural han permitido identificar la principal región de la proteína que participaría en la unión con el receptor.
Por otro lado, el estudio comparativo del perfil de expresión génica de la proteína nativa y la variante no catalítica ha mostrado la participación de la actividad ribonucleasa en la inducción de vías características de la respuesta de defensa antivírica, entre ellas la vía asociada al interferón. A partir del estudio comparativo de macrófagos infectados con micobacterias y con el virus sincitial respiratorio (virus encapsulado de cadena sencilla de RNA) se muestra cómo el bloqueo específico de la vía de activación del receptor EGFR, inhibe la actividad bactericida pero no la acción antivírica de la proteína.
El trabajo destaca el mecanismo de acción polifacético de una proteína de secreción de nuestro sistema inmunitario innato y abren las puertas al diseño dirigido de nuevos agentes terapéuticos. Los resultados se han publicado en la revista Cellular and Molecular Life Sciences.
Lu Lu1, RanLei Wei2, Guillem Prats-Ejarque, Maria Goetz1, Gang Wang2, Marc Torrent1 & Ester Boix1
1Departamento de Bioquímica y Biología Molecular, Facultad de Biociencias, Universitat Autònoma de Barcelona.
2Centro de Medicina de Precisión y Laboratorio clave de Medicina de precisión de la provincia de Sichuan, Hospital del Oeste de China.
Referencias
Lu, L., Wei, R., Prats-Ejarque, G. et al. Human RNase3 immune modulation by catalytic-dependent and independent modes in a macrophage-cell line infection model. Cell. Mol. Life Sci. (2020). https://doi.org/10.1007/s00018-020-03695-5


