Rol del residuo Gln596 en el funcionamiento de ALOX15, una enzima crucial para la salud
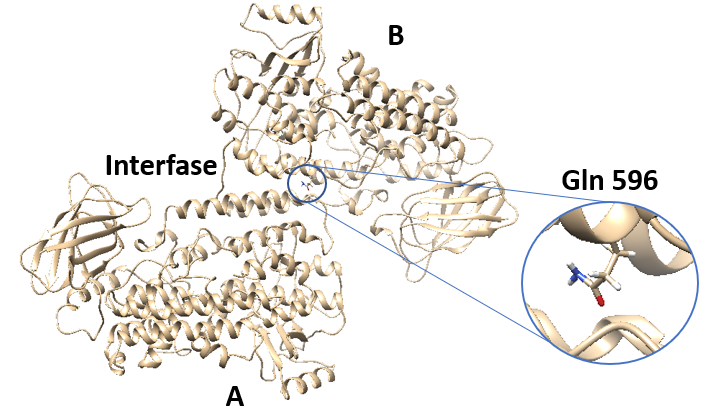
Actualmente se sabe que enfermedades como la arterioesclerosis o la osteoporosis están relacionadas con la actividad de la enzima ALOX15. Un estudio realizado por el grupo de investigación del área de Física-Química del Departamento de Química de la UAB ha observado en varios experimentos el papel del residuo Gln596 para la estabilidad de dicha enzima, muy importante para controlar el desarrollo de este tipo de afecciones.
En el campo de las proteínas, las enzimas 15-lipoxigenasas (ALOX15; arachidonate 15-lipoxygenase) tienen una gran relevancia ya que están relacionadas con los procesos inflamatorios y un gran número de enfermedades, como por ejemplo la arterioesclerosis y la osteoporosis. ALOX15 son unas enzimas que contienen hierro, pero no un grupo hemo, las cuales catalizan la dioxigenación estereoselectiva del ácido araquidónico (AA) a una mezcla de ácidos 12- y 15- hidroperoxieicosatetranoicos (12- y 15-HpETE) que inician la biosíntesis de compuestos de señalización que son cruciales para la salud humana.
Aunque ALOX han sido consideradas como enzimas monoméricas, datos recientes de ALOX15 de conejo en solución acuosa sugieren que hay un equilibrio dinámico entre la forma monomérica y dimérica de la enzima. Este dímero consiste en dos monómeros (A y B) estructuralmente diferentes que interaccionan a través de hélices α, concretamente las hélices α2 y α18 de cada monómero. Gln 596 es un residuo que se encuentra en la parte final de la hélice α18 y que se conserva en un gran número de ALOX15 de mamíferos. Por todo esto, con el objetivo de determinar el rol de este residuo, se han realizado experimentos con ALOX15 de conejo, ALOX15 humana y diferentes mutantes de estas enzimas, utilizando diferentes sustratos. En estos mutantes se intercambia Gln 596 por otros residuos, cuyas posibles interacciones diferirán completamente de las interacciones del residuo en cuestión.
Además, se han construido mediante técnicas computacionales modelos diméricos in silico de ALOX15 de conejo y de los diferentes mutantes considerados para esta enzima, con los cuales se han llevado a cabo simulaciones de dinámica molecular (DM). En los experimentos realizados en este trabajo se ha podido observar que la mutación de Gln 596 induce una serie de alteraciones funcionales en la enzima, como por ejemplo en la cinética de la reacción, en la selectividad del sustrato o en la especificidad de la reacción. Nuestras simulaciones sugieren que el origen de estos cambios está en que Gln 596 influye en la geometría del centro catalítico mediante interacciones indirectas, es decir, Gln 596 no interacciona directamente con los residuos que conforman el centro catalítico, sino que interacciona con otros residuos que son los que influyen alostéricamente en la forma del centro activo de la enzima.
Por otra parte, la mutación de este residuo también induce cambios en la estructura secundaria, la cual pierde contenido en hélices α en favor de láminas beta y bucles, y en las propiedades alostéricas de la enzima. Esto parece ser debido a que se pierden interacciones entre Gln 596 y la hélice α2 del monómero A, lo cual acaba desestabilizando la formación del dímero y acaba teniendo un impacto tanto en la estructura secundaria como en las propiedades alostéricas.
Las simulaciones de DM también han sido claves para determinar el papel de Gln 596 en la fijación del sustrato. A pesar de que se creía que era en este residuo donde se fija el grupo carboxilato de los diferentes sustratos que puede tener la enzima, se ha comprobado que no es así y en caso de producirse esta unión, se trataría de una interacción desfavorable desde un punto de vista de la reactividad del sustrato.
Alejandro Cruz1, Àngels González-Lafont1,2, José M. Lluch1,2
1Departament de Química, Universitat Autònoma de Barcelona.
2Institut de Biotecnologia i de Biomedicina, Universitat Autònoma de Barcelona.
Referencias
Cruz, A.; Di Venere, A.; Mei, G.; Zhuravlev, A.; Golovanov, A.; Stehling, S.; Heydeck, D.; Lluch, J. M.; González-Lafont, À.; Kuhn, H.; Ivanov, I. A Role of Gln596 in Fine-Tuning Mammalian ALOX15 Specificity, Protein Stability and Allosteric Properties. Biochim. Biophys. Acta - Mol. Cell Biol. Lipids 2020, 1865 (7), 158680. https://doi.org/10.1016/j.bbalip.2020.158680.


