La interacción de ALDH1A3 con ATP: nuevas evidencias sobre su función en cáncer, diabetes y obesidad
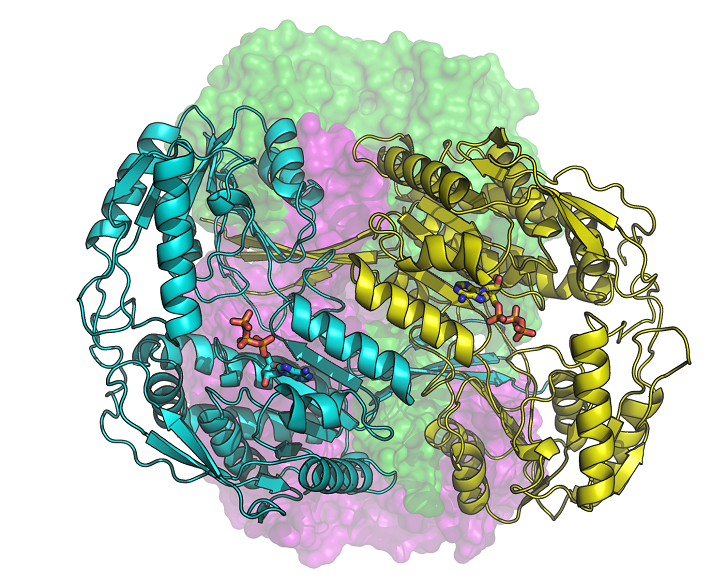
La aldehído deshidrogenasa 1A3 (ALDH1A3) humana es la enzima que une un ATP, a la vez que biomarcador de las células iniciadoras de tumores, responsables de la resistencia a la quimioterapia. Según un estudio del Departamento de Bioquímica y Biología Molecular de la UAB en colaboració con el Sincrotrón ALBA, su silenciamiento restablece la sensibilidad de las células tumorales a los agentes quimioterapéuticos.
Los enzimas son proteínas catalizadoras que aceleran reacciones biológicas específicas. La aldehído deshidrogenasa 1A3 (ALDH1A3) humana pertenece a un grupo de enzimas especializados en la oxidación de aldehídos a sus ácidos carboxílicos, con la colaboración del dinucleótido de nicotinamida y adenina (NAD), que actúa como cofactor. Estos enzimas se ocupan de eliminar aldehídos, compuestos químicamente muy reactivos y con frecuencia tóxicos, participando, entre otros, en la vía metabólica del alcohol, así como en el metabolismo hormonal. Son también activos en la defensa celular frente a drogas y fármacos, como aquéllos que o bien son aldehídos o actúan aumentando la producción de radicales libres y la peroxidación de lípidos. En particular, la ALDH1A3 se encuentra en el citoplasma celular y se expresa de forma habitual en diferentes órganos y tejidos, como las glándulas salivares, el estómago o el riñón. Una de sus funciones fisiológicas es la producción de ácido retinoico, derivado de la vitamina A, mediante el cual se regula la expresión de múltiples genes que controlan a su vez procesos vitales como la proliferación y la diferenciación celular. Existen numerosos estudios que demuestran que la alteración de la actividad enzimática de la ALDH1A3 está asociada a enfermedades como el cáncer, la diabetes y la obesidad.
La ALDH1A3 también es un biomarcador de células madre del cáncer, también llamadas células iniciadoras de tumores. Se cree que estas células son en gran parte las responsables de la aparición de resistencia a la quimioterapia, así como de la recidiva y la metástasis en la enfermedad cancerosa. En los últimos años, la ALDH1A3 se ha convertido en una nueva diana terapéutica y, de hecho, su silenciamiento restablece la sensibilidad de las células tumorales a los agentes quimioterapéuticos. Así, el bloqueo de la actividad ALDH1A3, a través de inhibidores (moléculas que se unen al enzima y disminuyen su activitad) farmacológicos administrados juntamente con anticancerígenos convencionales, podría contribuir a mejorar su respuesta terapéutica. Por este motivo, el estudio de las relaciones estructura-función de la ALDH1A3 puede abrir la puerta al diseño racional de nuevos agentes terapéuticos.
En el manuscrito publicado en la revista Communications Biology describimos por primera vez la estructura molecular de tres configuraciones de la ALDH1A3, obtenidas mediante cristalografía de rayos X en la línea de luz XALOC del Sincrotrón ALBA. Las nuevas estructuras han permitido conocer con precisión la posición de los átomos del enzima y cómo se une a su cofactor NAD o al ATP, también conocido como “la moneda energética de la célula”.
Del estudio destaca el descubrimiento de la unión de la molécula de ATP a un miembro de la superfamilia ALDH. Se observa, además, que el ATP actúa como inhibidor reversible de la ALDH1A3, por lo que podría modular su actividad al cambiar el estado energético de la célula. Por otro lado, se conoce que los niveles intracelulares de ATP son más elevados en células tumorales y, especialmente en aquéllas que se han vuelto resistentes a fármacos, que en células normales o sensibles a fármacos del mismo origen celular. Además, la ALDH1A3 es más abundante en células cancerosas, lo que puede favorecer la producción de ATP. Por el contrario, la inhibición del enzima en células cancerosas conduce a una disminución significativa del consumo de glucosa y a una reducción de la producción de lactato y ATP. Esta modulación de la actividad ALDH1A3 por parte del ATP podría ser también relevante en otras patologías, como la diabetes y la obesidad.
En resumen, los resultados derivados de este trabajo nos permiten especular que el estado energético de la célula está asociado a la ALDH1A3 y a su papel potencial en la reprogramación metabólica provocada por enfermedades como el cáncer, la diabetes y la obesidad. Además, la disponibilidad de las nuevas estructuras tridimensionales de alta resolución favorecerá el diseño racional de inhibidores contra ALDH1A3 y puede impulsar el descubrimiento de nuevos fármacos.
Este trabajo ha sido realizado por el Dr. Albert Castellví y la Dra. Raquel Pequerul, del grupo de investigación del Departamento de Bioquímica y Biología Molecular de la UAB, liderado por los Dres. Jaume Farrés y Xavier Parés, en colaboración con la Dra. Judith Juanhuix del Sincrotrón ALBA.
Referencias
Castellví A, Pequerul R, Barracco V, Juanhuix J, Parés X, Farrés J. Structural and biochemical evidence that ATP inhibits the cancer biomarker human aldehyde dehydrogenase 1A3. Commun Biol. 2022 Apr 13;5(1):354. DOI: 10.1038/s42003-022-03311-1.


