Identifican una nueva enzima digestiva
23/04/2018
Las proteínas y péptidos que ingerimos son componentes esenciales de nuestro organismo, hasta el punto que casi la mitad de las unidades que forman nuestras proteínas, los aminoácidos, se obtienen únicamente a partir la alimentación. Son los llamados aminoácidos esenciales (el resto los podemos sintetizar directamente a nuestras células). Este proceso se denomina digestión y las enzimas proteolíticas, presentes en nuestro sistema digestivo, juegan un papel muy importante a la hora de romper o “digerir” los péptidos y proteínas de los alimentos en estas unidades más pequeñas para que puedan ser absorbidas en el intestino y reutilizadas.
De entre todas las enzimas proteolíticas presentes en el sistema digestivo, las carboxipeptidasas juegan un papel esencial en la liberación de los aminoácidos. Hasta ahora se conocían carboxipeptidasas con actividad sobre casi todos los 20 aminoácidos que forman las proteínas, pero faltaba encontrar una clase de carboxipeptidasas que liberen aminoácidos que tienen cargas negativas (glutámico y aspártico, importantes biológicamente).
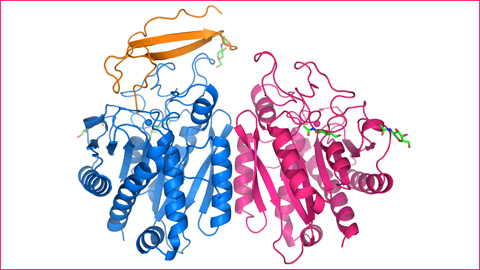
En el trabajo que los investigadores acaban de publicar en la revista PNAS, revista científica de la Academia de Ciencias de USA, presentan la caracterización estructural y el mecanismo de acción de una nueva carboxipeptidasa del intestino delgado, llamada CPO, que presenta especificidad de reconocimiento frente estos aminoácidos.
La estructura tridimensional de esta enzima, obtenida gracias a la cristalografía de proteínas y la luz del sincrotrón ALBA, ha permitido observar claramente que la presencia de un solo aminoácido de arginina en el bolsillo de especificidad de la enzima es suficiente para conferir esta capacidad de reconocer y digerir péptidos y proteínas con aminoácidos cargados negativamente.
De este modo, la combinación de la actividad de la CPO, descrita en esta investigación, con la de las ya conocidas carboxipeptidasas pancreáticas, completan el abanico de la digestión de la gran mayoría de proteínas de nuestra alimentación, un proceso indispensable para la vida.
El trabajo se ha realizado gracias a una colaboración entre el grupo de los Dres. Francesc X. Avilés y Júlia Lorenzo, con una larga trayectoria en el estudio de estas enzimas proteolíticas, y David Reverter, que dirige el grupo de cristalografía de proteínas, donde se ha caracterizado la estructura tridimensional de la CPO. También hay que destacar la colaboración del premio Nobel de Química, Dr. Robert Huber, del Instituto Max Planck de Bioquímica de Munich (Alemania), que ha participado activamente.
Referencia: Garcia-Guerrero MC, Garcia-Pardo J, Berenguer E, Fernandez-Alvarez R, Barfi GB, Lyons PJ, Aviles FX, Huber R, Lorenzo J, Reverter D. (2018). Crystal structure and mechanism of human carboxypeptidase O: Insights into its specific activity for acidic residues. Proc Natl Acad Sci USA. DOI: 10.1073/pnas.1803685115.