La disfunción telomérica promueve la pérdida de cromosomas enteros en células primarias
La presencia de inestabilidad cromosómica en las células refleja la presencia de defectos en los procesos celulares que mantienen la estabilidad del genoma. En este sentido, el mantenimiento de la longitud de los telómeros juega un papel muy importante en la protección del genoma frente a procesos de recombinación y/o degradación.
En presencia de telómeros disfuncionales, los cromosomas se fusionan los unos con los otros formando cromosomas con dos o más centrómeros (secuencias de ADN, con un papel importante en la división celular, por donde se unen las dos partes o cromátidas de un cromosoma). Estos cromosomas dicéntricos desencadenan inestabilidad cromosómica de tipo estructural, ya que pueden romperse y reorganizarse de nuevo durante la anafase (etapa de la división celular en que se separan las dos cromátidas que componen los cromosomas) y a lo largo de sucesivas divisiones.
Este hecho conocido como ciclo BFB (del inglés breakage-fusion-bridge) fue descrito por Barbara McClintock en los años 40. Esta situación aparece cuando los dos centrómeros de una misma cromátida dicéntrica son estirados hacia polos opuestos de la célula, lo que resulta en la aparición de un puente de cromatina. La tensión constante ejercida sobre el puente desencadena finalmente la ruptura de esta estructura, y genera unos extremos cromosómicos rotos capaces de reorganizarse de nuevo durante el siguiente ciclo celular.
Las células que presentan inestabilidad cromosómica -como las tumorales- además de presentar anomalías en la estructura de los cromosomas también presentan números anormales de cromosomas, estado conocido como aneuploidía. Mientras la generación de anomalías estructurales se ha relacionado con la presencia de disfunción telomérica, una relación clara entre la aneuploidía y la desprotección de los telómeros no se ha establecido. Para establecer una posible conexión entre ambos parámetros, se analizó la ganancia y la pérdida de cromosomas en células epiteliales mamarias humanas (HMECs), las cuales exhiben niveles crecientes de disfunción telomérica a medida que son cultivadas in vitro.
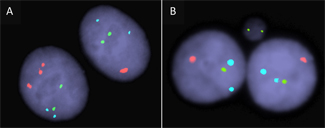
Se aplicaron técnicas de hibridación in situ con fluorescencia (FISH) con sondas centroméricas-técnica que permite evaluar, a través de un microscopio de fluorescencia, la aneuploidía de cromosomas de interés- en HMECs binucleadas donde se había impedido artificialmente la división citoplasmática de la célula. Esta estrategia permite evaluar la correcta repartición (segregación) de los cromosomas homólogos entre los dos núcleos hermanos tras la división celular (ver esquema adjunto). Mientras que segregaciones normales resultan en dos señales centroméricas cada núcleo, segregaciones anómalas ocasionan variaciones en el patrón de señales centroméricas por núcleo. Concretamente, pueden distinguirse reparticiones desiguales de los cromosomas entre los dos núcleos hermanos (no-disyunción) o la pérdida de un cromosoma en forma de micronúcleo -estructura similar al núcleo pero de menor tamaño (pérdida anafásica)-.
Esquema que ilustra segregaciones correctas (fila superior) y erróneas (fila inferior) de tres cromosomas concretos. La distribución correcta de cada cromosoma resulta en la presencia de dos señales centroméricos en cada núcleo hermano (distribución 2:2). Por el contrario, repartos erróneos como los que resultan de procesos de no-disyunción o pérdida anafásica originan células binucleadas aneuploides con distribuciones 3:1 o 1:2, respectivamente.
En las HMECs los estadios tempranos del cultivo, sólo unos determinados cromosomas exhiben disfunción telomérica, lo que permite comparar la evolución de cromosomas con disfunción telomérica con cromosomas de longitud telomérica no disfuncional a medida que las células proliferan. En nuestro trabajo se comparó las anomalías cromosómicas numéricas de dos cromosomas con disfunción telomérica (cromosomas 1 y 22) con la mostrada por un cromosoma con telómeros no disfuncionales (cromosoma 4).
Los resultados demostraron que, en un ambiente con niveles crecientes de disfunción telomérica, los cromosomas con telómeros disfuncionales segregan erróneamente con una probabilidad mayor que los otros cromosomas. En nuestro estudio, la no disyunción prevaleció hacia la pérdida anafásica. Todo ello demuestra que la disfunción telomérica no sólo es capaz de generar anomalías cromosómicas estructurales sino que también promueve la aparición de aneuploidías.
La disfunción telomérica puede dar lugar a la segregación errónea de cromosomas dicéntricos cuando la tensión ejercida sobre el puente anafásico provoca que éste, en vez de romperse, se libere de su unión a los microtúbulos de uno o ambos polos del huso (ver esquema a continuación). Entonces, el puente intacto, puede quedar englobado en uno de los dos núcleos de las células hijas, lo que resulta en no-disyunción, o puede formar un micronúcleo.
Posibles errores de segregación de los cromosomas dicéntricos durante la mitosis. Cuando la región intercentromérica de un cromosoma dicéntrico se dobla, se formará un puente de cromatina durante la anafase. Este puente cromatínico formado (A) puede romperse. Este hecho resulta en anomalías cromosómicas estructurales. (B) Cuando la cromátida dicéntrica se libera de uno de los polos, la tensión ejercida por los microtúbulos del polo opuesto arrastran todo el cromosoma hacia el polo opuesto originando una no-disyunción. En este caso, una de las células hijas recibirá un cromosoma entero que faltará otra célula hermana. (C) Por último, si el cromosoma dicéntrico se libera de los microtúbulos de ambos polos y permanece en el ecuador de la célula, mientras todos los demás cromosomas se mueven en dirección a los polos, puede quedar finalmente excluído de los núcleos principales y ser finalmente incorporado en un micronúcleo.
Referencias
"Whole chromosome loss is promoted by telomere dysfunction in primary cells". Pampalona J, Soler D, Genescà A, Tusell L. Genes Chromosomes Cancer. 2010 Apr;49(4):368-78.


