Alternativas a los antibióticos: estudio comparativo entre ribonucleasas
En nuestro grupo de investigación estamos estudiando las ribonucleasas antimicrobianas humanas. Estas proteínas del sistema inmunitario innato presentan actividad antipatógena y pertenecen a una de las primeras líneas de defensa del cuerpo contra las infecciones. Las proteínas y péptidos antimicrobianos son liberados en respuesta a los procesos de infección y de inflamación y actúan provocando la muerte de los microorganismos responsables. Al mismo tiempo, pueden modular parte de la acción de conjunto del sistema inmunitario para controlar la extensión del patógeno y regular los procesos de sepsis.
El uso generalizado de los antibióticos y, a veces, su abuso o mal uso ha generado la aparición de cepas de microorganismos resistentes a estos fármacos que, en algunos ambientes, como en el caso de los hospitales, pueden ser especialmente problemáticos.
El aumento preocupante de las resistencias a determinados tipos de antibióticos ha llevado a los laboratorios de investigación y a las empresas farmacéuticas a desarrollar nuevos fármacos con una actividad similar a la de los antibióticos, con la esperanza de minimizar el riesgo de resistencias.
En este punto, los péptidos antimicrobianos se presentan como una posible alternativa a los antibióticos convencionales. Estos péptidos presentan un amplio espectro de actividad, una baja toxicidad para el cuerpo humano y una menor susceptibilidad a generar resistencias.
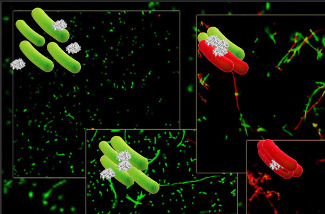
Una de las actividades menos estudiadas de estas proteínas y péptidos es su capacidad de aglutinar a los microorganismos, principalmente bacterias. Este efecto consiste en agregar a nivel local una gran cantidad de microorganismos, lo que permite al cuerpo humano localizar mejor el foco de infección y utilizar su armamento molecular de forma mucho más eficaz.
Nosotros hemos estudiado dos ribonucleasas antimicrobianas que pese a ser muy similares en su estructura presentan efectos muy diferentes. Estas dos proteínas pertenecen a la familia de enzimas de la RNasa A, una de las primeras proteínas de las que se conoció su estructura y actividad catalítica a los estudios pioneros de los años 60. Durante los últimos años se ha descrito que algunos miembros de la familia con actividad citotóxica pueden participar en el sistema inmunitario innato y contribuir a la lucha contra las infecciones, tanto a bacterias, virus o parásitos.
Para poder descubrir cómo funcionan estas dos proteínas hemos utilizado una estrategia múltiple, con herramientas de predicción informática (Torrent et al, BMC Bioinformatics 10, 373, 2009), modelos de membrana sintética (Torrent et al., BBA, 1788, 1116, 2009) y diseño de péptidos derivados (Torrent et al., Biochem J 421, 425, 2009). En este último trabajo los sistemas biofísicos sencillos se han completado con la visualización en vivo por microscopía electrónica y confocal de su comportamiento en cultivos bacterianos.
A pesar de la semejanza en su secuencia y estructura, las dos ribonucleasas presentan un mecanismo de acción antimicrobiana muy diferente y sólo una de ellas, la ribonucleasa 3, también llamada proteína catiónica de eosinófilos (ECP), presenta efectos aglutinantes. En este estudio se ha propuesto que esta actividad podría ser dirigida por una zona hidrofóbica expuesta y una región de unión a lipopolisacáridos, ambas ubicadas en el extremo N-terminal de la proteína.
La ribonucleasa derivada de piel, o RNasa 7, la otra proteína estudiada, no presenta ni efectos de aglutinación ni ninguna zona hidrofóbica expuesta. En cambio, esta proteína tiene una alta actividad lítica tanto en cepas bacterianas gram-positivo como gram-negativo.
La existencia de dos proteínas homólogas con mecanismos de acción diferenciados podría ayudar a entender cuáles son los determinantes que dirigen uno u otro proceso y, por tanto, profundizar en el diseño de péptidos antimicrobianos capaces de combatir las infecciones por microorganismos resistentes a los antibióticos.
Referencias
"Comparison of human RNase 3 and RNase 7 bactericidal action at the Gram-negative and Gram-positive bacterial cell wall". Torrent, M; Badia, M; Moussaoui, M; Sanchez, D; Nogues, MV; Boix, E. FEBS JOURNAL, 277 (7): 1713-1725 APR 2010.


