Mezclando cationes de cobalto con cadenas de glicina dentro de un ordenador
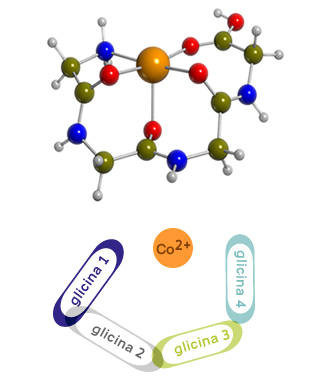
Un grupo de investigación, formado por químicos de la UAB, ha simulado por ordenador las estructuras tridimensionales más estables de ciertas biomoléculas de cobalto. Estas consisten en péptidos coordinados al átomo metálico pero, para favorecer los cálculos computacionales, se ha simplificado el sistema considerando los aminoácidos más sencillos como la glicina. Los resultados apuntan a un incremento en el número de coordinación del metal al aumentar la longitud de la cadena, para el caso del Co2+, mientras que por el catión Co+ la estructura más favorecida es tricoordinada.
Muchos procesos biológicamente importantes requieren la participación de un catión metálico e implican la interacción de éste con las biomoléculas que se encuentran en los seres vivos. En muchos casos intervienen las proteínas, cadenas formadas por unidades (aminoácidos) que se van enlazando entre ellas, como los eslabones de una cadena. El tipo de aminoácidos y la manera en la que se unen determinan la forma y la función de la proteína. Hay que decir que los aminoácidos se enlazan a través de los mismos átomos, formando un tipo de unión denominada enlace peptídico. Además, contienen átomos (normalmente nitrógeno (N), oxígeno (O) o azufre (S)) que pueden actuar como punto de anclaje (de interacción) de los cationes metálicos. La preferencia de los cationes metálicos por unos u otros átomos del péptido dependerá de su naturaleza química (no es lo mismo un catión de Fe3+ que un de Zn2+), así como el número de átomos que rodean el catión.
Así, cuanto más grande es el péptido (la cadena de aminoácidos), más puntos de interacción presenta; por lo tanto, más posibilidades diferentes de interacción del catión (más posibilidades de estructuras diferentes). De estas, suele haber una, o unas pocas, que son las más favorables, las más estables. Poder conocerlas y estudiar el tipo de interacción que se establece entre el catión y el péptido puede ser de gran ayuda para entender mejor la importancia biológica de los cationes metálicos. Aun así, el tamaño de una proteína hace inviable este estudio mediante técnicas computacionales, por lo cual, un primer paso seria el estudio de la interacción de un catión metálico con péptidos pequeños constituidos por diferentes aminoácidos o únicamente por glicina, puesto que es el aminoácido más pequeño. Estos tipos de trabajos han experimentado un crecimiento en las últimas dos décadas gracias, no sólo a los adelantos de la informática (técnicas computacionales), sino también a los adelantos en la espectrometría de masas.
En este artículo hemos estudiado la interacción de los cationes metálicos de Cobalto Co+ y Co2+ con tres péptidos pequeños de glicina, los cuales contienen desde 2 hasta 4 unidades de este aminoácido. El motivo de la elección de estos cationes es doble. Desde el punto de vista químico y computacional, porque pueden presentar diferentes estados electrónicos; es decir, varias maneras de distribuir los electrones en los orbitales. Suponemos que tenemos 5 viviendas, que pueden encontrarse vacías o habitadas por un o por 2 inquilinos. Cada vivienda representaría un orbital y cada inquilino, un electrón. El Co+ tiene 8 electrones para repartirse, 8 inquilinos, que se podrían distribuir de las siguientes maneras: a) 3 viviendas con 2 inquilinos y dos pisos con sólo una persona en cada uno o, b) 4 viviendas llenas y 1 completamente de vacía. Las dos situaciones (triplete y singulete, respectivamente) corresponderían a dos estados electrónicos diferentes a nivel químico. Habitualmente un estado es más estable que el otro. En el caso del Co2+, habría 7 electrones para distribuir. Además, estos dos cationes presentan una importancia biológica: el Co2+ se encuentra en las cobalaminas, como la vitamina B12, mientras que el Co+ participa en algunos de los procesos de las cobalamines. Aunque, en determinadas concentraciones, también pueden resultar tóxicos.
El objetivo de estudiar la interacción de cadenas de glicina con cationes de Cobalto es la de determinar cómo son las estructuras más estables, los puntos de interacción, así como la energía de interacción entre el catión y el péptido, todo esto mediante herramientas computacionales (empleando métodos del funcional de la densidad). Para las tres cadenas escogidas se ha encontrado que, para el Co+, el estado electrónico más estable es siempre el triplete y las estructuras más favorecidas de tipos tricoordinado: el catión interacciona con 3 átomos de la cadena, normalmente oxígenos. Para el Co2+, el número de átomos que interaccionan con el catión aumenta al aumentar la longitud de la cadena. Para ambos cationes, el alargamiento de la cadena de glicinas repercute en un incremento de la energía de interacción (hace falta más energía para romper sus enlaces). Así pues, la química computacional permite la obtención de información valiosa sobre la estructura de moléculas y complejos.
Referencias
"Coordination of (Glycyl)(n)glycine (n=1-3) to Co+ and Co2+". Constantino, Erika; Rimola, Albert; Sodupe, Mariona; Rodríguez-Santiago, Luis. JOURNAL OF PHYSICAL CHEMISTRY A, 113 (31): 8883-8892 AUG 6 2009.


