Evaluada una nueva técnica rápida para detectar tuberculosis resistente
La mortalidad por tuberculosis ya no sólo es un problema del tercer mundo. Los datos son claros: el número de casos en países desarrollados aumenta progresivamente. Si, además, tenemos en cuenta que el número de cepas resistentes a los fármacos de primera línea también ha crecido, la situación puede ser grave. Para controlar adecuadamente la enfermedad es necesario diagnosticar a las personas enfermas antes de que el afectado pueda infectar a otra persona. Para conseguirlo, una de las posibilidades es la detección de las mutaciones responsables de las resistencias en el DNA del Mycobacterium tuberculosis -el microorganismo que causa la enfermedad-. El siguiente artículo ha evaluado la eficacia de una técnica molecular para la detección de resistencias ( Genotype MTBDRplus), y l os resultados son favorables dado que el porcentaje de concordancia con respecto a la técnica convencional ha sido bastante elevado y, por lo tanto, se ha podido detectar con rapidez la resistencia a dos de los fármacos antituberculosos más utilizados.
La tuberculosis continúa matando a 2 millones de personas cada año. Aunque el problema es especialmente grave en países en vías de desarrollo, la incidencia de la enfermedad también está aumentando en nuestro medio. El aumento de cepas de la bacteria resistentes a los fármacos de primera línea (más eficientes y menos tóxicos) agravan la situación. El lento crecimiento de Mycobacterium tuberculosis, el bacilo causante de la enfermedad, hace que se retrase varías semanas el resultado del estudio de susceptibilidad en los antimicobacterianos, de forma que si un enfermo está infectado con una cepa multi-resistente, el riesgo de que la transmita y contagie a sus contactos antes de que se detecte la situación, es muy elevado. Para detectar precozmente estas cepas, se han desarrollado diferentes técnicas moleculares que detectan en el ADN del bacilo en las principales mutaciones que causan las resistencias, de forma que no hay que esperar al cultivo y la detección de la resistencia es mucho más rápida.
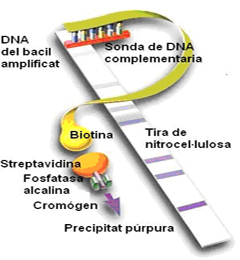
Ejemplos de posibles resultados y descripción de la sonda que hay fijada en cada lado.
Por este motivo, quisimos evaluar la utilidad de una técnica que combina una fase de amplificación mediante PCR con una técnica de hibridación reversa en tiras de nitrocelulosa (Genotype MTBDRplus) para la detección de resistencias en la rifampicina (mutaciones en el gen rpoB) y la isoniazida (mutaciones en los genes inhA y katG), comparando con los resultados de detección fenotípica convencional (BACTEC 460TB) y en el caso de las cepas clínicas con la secuenciación. El ensayo se evaluó en 62 cepas clínicas de M. tuberculosis y en 65 muestras clínicas directas (39 con resultado de examen microscópico positivo y 26 con resultado negativo). La concordancia global entre los resultados de MTBDRplus y BACTEC 460TB para la detección de susceptibilidad en cepa clínica fue de 98.3% por la rifampicina y de 79% para la isoniazida. Respecto a las muestras clínicas directas, se obtuvieron resultados válidos en el 78.45% de las muestras. En estas, la concordancia entre MTBDRplus y BACTEC 460 fue de 98% para la rifampicina y de 96.2% para la isoniazida. La concordancia es menor para la Isoniazida debido a que las mutaciones causantes de la resistencia en las cepas que tienen bajo nivel de resistencia se encuentran en genes poco estudiados que no se analizan en el test.
Con los resultados obtenidos podemos concluir que la técnica evaluada es una herramienta útil y práctica para el manejo de la tuberculosis, ya que permite la detección rápida de resistencias en los dos principales fármacos antituberculosos en cepas y muestras clínicas directas.
Referencias
GenoType MTBDRplus Assay for Molecular Detection of Rifampin and Isoniazid Resistance in Mycobacterium tuberculosis Strains and Clinical Samples. A. Lacoma, N. Garcia-Sierra, C. Prat, J. Ruiz-Manzano, L. Haba, S. Rosés, J. Maldonado, and J. Domínguez. JOURNAL OF CLINICAL MICROBIOLOGY, Nov. 2008, p. 3660?3667


