Descubierto un mecanismo que puede causar enfermedades genéticas
Las células producen cada día miles de nuevas proteínas, que se renuevan cada segundo y que, obedeciendo las órdenes escritas en nuestro código genético, trabajan para conseguir el funcionamiento normal de nuestro cuerpo. Aun así, a veces, las proteínas pueden sufrir una mutación genética que puede provocar cambios en su composición, impidiendo que logren su forma funcional y realicen las actividades que tienen asignadas. Esto acaba dando lugar, en muchos casos, a la formación de macromoléculas de agregados tóxicos -las fibras amiloides-, que bloquean el sistema de control de calidad proteica de nuestro cuerpo y acaban provocando la muerto celular.
La agregación proteica y el plegamiento incorrecto de las proteínas se halla en el origen de muchas enfermedades denominadas conformacionales, que pueden ser de origen genético o de aparición espontánea. Las proteínas que están implicadas pueden tener una forma desestructurada o lineal, desplegada, como en el Alzheimer, el Párkinson o la Diabetes Tipo II, o globular, mostrando una estructura tridimensional y replegadas sobre ellas mismas. Las primeras han sido ampliamente caracterizadas por los investigadores y se conoce el proceso por el cual se despliegan, dejando al descubierto las regiones peligrosas con tendencia a agregar y volviéndose tóxicas. De las globulares, en cambio, que se sabe que están asociadas a graves enfermedades hepáticas, cardíacas, renales o neurológicas, no se conocía de manera clara cómo podían agregarse, aunque se encontraran bien plegadas en nuestro organismo.
Mediante análisis computacional, los investigadores Salvador Ventura y Virginia Castillo han descubierto que las proteínas globulares implicadas en enfermedades conformacionales genéticas, en condiciones de no enfermedad, se encuentran asociadas en parejas a otras proteínas o en complejos de más subunidades, del tal manera que lo que hace una de las proteínas es tapar la región con tendencia a agregar de la otra, evitando el desencadenamiento de este proceso. Así, estas regiones permanecen ocultas en el interior de su estructura siendo inofensivas para el organismo mientras las dos proteínas están encajadas. Los investigadores han encontrado que mutaciones genéticas producidas en la región de interacción de la pareja de proteínas evita su asociación, dejando al descubierto las regiones susceptibles de agregar y favoreciendo su toxicidad. Esto explicaría, según los investigadores, porque si hay dos personas con las mismas proteínas globulares y con las mismas regiones peligrosas, la persona que sufre la mutación sufre la enfermedad y la otra no.
Las conclusiones obtenidas lleva a los investigadores a contemplar la posibilidad que la disociación de proteínas sea un mecanismo general, que no sólo afecte a proteínas globulares de estructura conocida, sino también otras todavía no caracterizadas que puedan estar detrás de enfermedades cuya causa todavía no se conoce.
Como posibles estrategias para evitar la disociación de proteínas, los autores proponen introducir mutaciones genéticas en ellas para fortalecer su asociación y el desarrollo de moléculas específicas que bloqueen las regiones peligrosas de las proteínas ya disociadas.
Los resultados del estudio de los investigadores de la UAB coinciden prácticamente en el tiempo con los que han obtenido investigadores de la Universidad de Cambridge, publicados en “Proceedings of the National Academy of Sciences”.
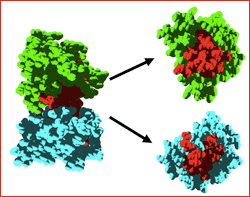
En un futuro, los investigadores planean extender su análisis computacional al conjunto de todas las proteínas humanas para las que se dispone de una estructura tridimensional. Esperan así encontrar las proteínas responsables de diferentes enfermedades genéticas, el origen de las cuales es todavía desconocido, y poder sugerir un conjunto de nuevas dianas terapéuticas para estos desórdenes. Imagen: Una de las parejas de proteínas globulares estudiada. La región peligrosa de ambas proteínas (región de interacción), en rojo, permanece oculta e inofensiva mientras permanecen unidas. La mutación genética provoca su separación, dejando al descubierto las regiones susceptibles de agregar y favoreciendo su toxicidad.
Referencias
"Amyloidogenic Regions and Interaction Surfaces Overlap in Globular Proteins Related to Conformational Diseases". Castillo V, Ventura S. PLoS Comput Biol. Volum 5, Issue 8, August 2009.


