Búsqueda de nuevos antibióticos para la erradicación de biopelículas bacterianas mediante una librería de péptidos
El abuso y mal uso de los antibióticos convencionales ha propiciado la aparición de cepas bacterianas resistentes. Urge el desarrollo de nuevos agentes antimicrobianos. En nuestro sistema inmunitario encontramos un amplio repertorio de proteínas y péptidos con actividad antimicrobiana, los péptidos antimicrobianos ejercen una acción rápida y multifacética, proporcionando un sistema atractivo alternativo a los antibióticos convencionales.
El grupo de investigación liderado por la Dra. Ester Boix trabaja en la caracterización de las ribonucleasas humanas de secreción, proteínas que forman parte de una familia específica de vertebrados y participan en el sistema inmunitario. En particular, la ribonucleasa 3 es una proteína altamente catiónica segregada por los eosinófilos durante los procesos infecciosos. Esta proteína, denominada también Proteína Catiónica de Eosinófilos, tiene una elevada afinidad por los lipopolisacáridos, moléculas aniónicas únicas de la membrana de las bacterias Gram-negativas. La unión de la proteína a la superficie de las bacterias promueve su aglutinación e induce la lisis y muerte celular. Curiosamente, el segmento N-terminal de la proteína puede reproducir la actividad antimicrobiana de la proteína parental.
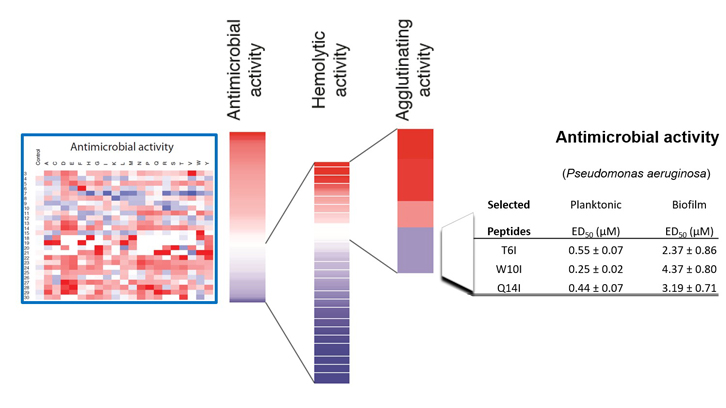
En este trabajo se ha realizado el clivaje de una librería de 500 péptidos gracias a la técnica de SPOT ideada en el laboratorio del Dr. Rudolf Volkmer de la Freie Universität de Berlín. Esta técnica permite la síntesis en un soporte de membrana de un gran número de péptidos y facilita su evaluación simultánea. El estudio del efecto posicional y de composición aminoacídica en cada una de las actividades específicas del péptido original muestra el frágil equilibrio entre su capacidad antimicrobiana y potencial toxicidad para las células del huésped, sugiriendo que la región de la proteína se habría optimizado a lo largo de la evolución para garantizar una actividad bacteriana eficiente y a la vez su inocuidad para el huésped. Aun así, se pudieron identificar unas pocas secuencias peptídicas que incrementaban la actividad antimicrobiana reduciendo la actividad hemolítica. Combinando la actividad de aglutinación y lisis celular de los péptidos seleccionados se evaluó frente a una cepa de Pseudomonas aeruginosa, especie que encabeza la lista de priorización de patógenos de la Organización Mundial de la Salud para la búsqueda de nuevos fármacos.
El péptido está patentado y pronto se ensayará su eficiencia en un modelo murino de infección (proyecto financiado pr el Programa Industria del Conocimiento, AGAUR: 2016 PROD-00060) con la cofinanciación de la Unión Europea a través del Fondo Europeo de Desarrollo Regional (FEDER).
El estudio se ha realizado en colaboración con el equipo del Dr. Rudolf Volmer (Freie Universität, Berlín) y el Dr. David Andreu (Universitat Pompeu Fabra). Los resultados se han publicado en la revista European Journal of Medicinal Chemistry.
Facultad de Biociencias
Universidad Autónoma de Barcelona
Referencias
Pulido D, Prats-Ejarque G, Villalba C, Albacar M, Moussaoui M, Andreu D, Volkmer R, Torrent M, Boix E. Positional scanning library applied to the human eosinophil cationic protein/RNase3 N-terminus reveals novel and potent anti-biofilm peptides. Eur J Med Chem. 2018 May 25;152:590-599. doi: 10.1016/j.ejmech.2018.05.012. Epub 2018 May 8. PubMed PMID: 29763807.


