Prostaglandines per tractar l'asma
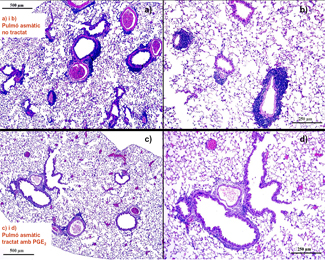
La complexitat i el desconeixement de gran part de la patogènia de l’asma al•lèrgica dificulten la identificació de noves dianes terapèutiques, un objectiu fonamental per una malaltia amb una incidència en augment en els països més desenvolupats. En la inducció de la disfunció respiratòria i de la inflamació al·lèrgica característiques de l’asma hi participen un entramat de mol·lècules i de cèl·lules immunitàries. Entre les moltes mol·lècules estudiades destaquen les prostaglandines (PG), productes de l’activitat de les ciclooxigenasses (COX). Investigacions recents en pacients asmàtics i en models d’asma en ratolí apunten cap al possible efecte protector d’algunes PG com la PGE2, particularment en el pulmó. No obstant això no es coneixen els mecanismes mitjançant els quals la PGE2 exerceix les seves accions beneficioses. A partir de nombrosos experiments in vitro i alguns in vivo es dedueix que l’efecte protector de la PGE2 en l’asma pot deure's als seus efectes antiinflamatoris i immunosupressors. S’ha demostrat per exemple que aquesta PG és capaç d’atenuar l’activitat mastocitària in vitro, mitjançant la seva interacció directa amb els receptors prostanoids (EP) presents en la seva superfície. Se sap que l’activació d’aquestes cèl·lules desencadena l’alliberament de diversitat de mediadors, molts dels quals podrien induir els fenòmens de hiperreactivitat bronquial (AHR: contracció exagerada de la musculatura llisa bronquial) i inflamació. Per tant, es pot pensar en la possibilitat de modificar in vivo la resposta asmàtica actuant sobre els mastòcits mitjançant l’ús d’agonistes o antagonistes dels receptors EP.
L’objectiu d’aquest estudi, ha estat avançar en el coneixement dels mecanismes protectors de la PGE2 en l’asma, per a la futura identificació de noves dianes terapèutiques antiasmàtiques. Per a això es va utilitzar un nou model d’asma al·lèrgica aguda induïda mitjançant l’exposició via intranasal de ratolins Balb/c a extractes d’àcars de la pols. En aquest model es va estudiar l'impacte de l’administració via subcutània d’agonistes dels receptors prostanoids PGE2 i sulprostona, un agonista dels receptors EP1/EP3, en la resposta respiratòria induïda per l’exposició a àcars de la pols en relació a la reactivitat bronquial, l’infiltra’t cel·lular pulmonar, el perfil de citosines Th1/Th2 i l’activitat dels mastòcits pulmonars en les vies respiratòries d’aquests ratolins.
L’exposició intranasal a àcars de la pols indueix una clara disfunció respiratòria (AHR) i una intensa inflamació de tipus Th2 amb predominança de eosinòfils i increment de la producció pulmonar de les citosines, IL-5 i IL-13. Paral·lelament a aquestes alteracions s’observa un marcat augment de l’activitat, però no del nombre, de mastòcits. El tractament dels ratolins amb PGE2 via subcutània atenua clarament el procés inflamatori, reduint sobretot el nombre d’eosinòfils. La disminució de la inflamació en els animals tractats s’acompanya d’una disminució de les citosines Th2, IL-5 i IL-13, la qual cosa suggereix que l’efecte de la PGE2 sobre la inflamació es deu en part a la seva capacitat d’atenuar la resposta Th2. A més, en els mateixos ratolins la PGE2 inhibeix amb claredat l’activitat dels mastòcits pulmonars, la qual cosa apunta directament cap als mastòcits com mediadors del paper atenuador de la inflamació que exerceix la PG. La sulprostona no reprodueix l’efecte de la PGE2 ni sobre la resposta inflamatòria ni sobre l’activitat dels mastòcits. Sota les condicions experimentals utilitzades, ni la PGE2 ni la sulprostona administrades via subcutània, alteren la AHR induïda per exposició a l’al·lèrgen.
Els nostres resultats contribueixen a consolidar el model induït per àcars de la pols com idoni per a la investigació bàsica dels mecanismes implicats en l’asma al·lèrgica i per a la recerca de dianes en el sistema COX/PGE2. Hem demostrat en el model de ratolí sensible a àcars de la pols l’efecte inhibitori de la PGE2 en la inflamació Th2 i hem suggerit que aquest efecte pot estar mediat per la reducció de l’activitat dels mastòcits pulmonars. Les troballes obtingudes en aquest treball conjuntament amb l’avanç en el coneixement dels mecanismes pels quals la PGE2 exerceix el seu efecte protector en l’asma, poden ajudar a identificar en el futur noves dianes terapèutiques.
Referències
Aida Herrerias, Rosa Torres, Mariona Serra, Alberto Marco, Jordi Roca-Ferrer, César Picado, Fernando de Mora. Subcutaneous prostaglandin E2 restrains airway mast cell activity in vivo and reduces airway eosinophilia and lung Th2 cytokine overproduction in a house dust mite-induced mouse model of asthma. Int Arch Allergy Immunol 2009 Mar 17, 149(4):323-332.


