Descrit un nou sistema de regulació de proteïnes
Les carboxipeptidases són uns enzims proteolítics, es a dir, proteïnes que tenen com a funció la degradació d’altres proteïnes o pèptids, que participen activament en processos digestius, de coagulació sanguínia o en la maduració d’hormones. Normalment aquests enzims tenen la seva funció fora de les cèl·lules en les quals són sintetitzats, encara que darrerament s’han trobat algunes subfamílies d’aquests enzims dins de la cèl·lula exercint importants funcions de control i regulació del creixement cel·lular, com ara la regulació de les diferents formes de la tubulina, un dels principals components de l’esquelet cel·lular.
El control de l’activitat enzimàtica i concretament de l’activitat carboxipeptidasa en aquest cas és clau per al correcte funcionament dels organismes vius. Curiosament, organismes tant distants en l’evolució com ara la patata, la sangonera, la paparra o un tipus de cuc intestinal han dissenyat sistemes que regulen la funció de les carboxipeptidases, inhibint la seva activitat proteolítica, i permetent la seva alimentació i creixement. Aquestes sistemes de regulació consisteixen en unes altres proteïnes que regulen l’activitat enzimàtica i que s’anomenen inhibidors proteics.
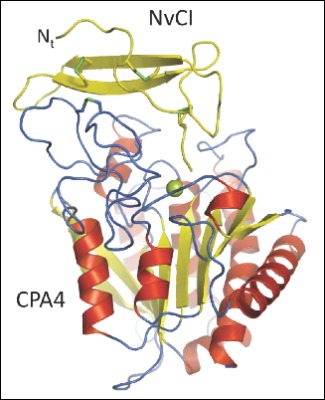
El grup de la UAB liderat per Francesc X. Aviles, que fa anys que estudia les carboxipeptidases, en col.laboració amb el grup de David Reverter, que lidera un grup de cristal.lografia de proteïnes, han publicat recentment en la prestigiosa revista Journal of Biological Chemistry un treball en el qual caracteritzen l’estructura tridimensional del complexe format per una carboxipeptidasa humana i un inhibidor proteic trobat recentment en un mol·lusc tropical marí anomenat Nerita versicolor. En aquest treball on el primer signant és Giovanni Covaleda, també s’ha col.laborat amb un grup de la universitat de l'Havana que ha proporcionat els extractes de l’organisme marí.
Tant sols es coneixen 4 tipus d’inhibidors de carboxipeptidases, tots ells d’organismes evolutivament distants, però que tenen en comú el mateix mecanisme inhibidor. De tots ells, aquest nou inhibidor de Nerita versicolor és el més potent trobat fins ara i la seva estructura tridimensional revela amb molt de detall el seu mecanisme d’inhibició. L’anàlisi atòmica d’aquestes interaccions entre l’enzim i l’inhibidor, realitzat per cristal·lografia de proteïnes, és molt útil a l’hora de dissenyar petits compostos que poden interferir en l’activitat enzimàtica i que poden ser de gran interès en la indústria farmacèutica i biotecnològica.
Els investigadors han utilitzat per a aquest treball llum de sincrotró, en aquest cas del de Grenoble, encara que esperen que en un futur molt proper puguin fer servir la llum del sincrotró ALBA.
Referències
Crystal structure of a novel metallo-carboxypeptidase inhibitor from the marine mollusk Nerita versicolor in complex with human carboxypeptidase A4. G. Covaleda, M. Alonso del Rivero, M. A. Chávez, F. X. Avilés, D. Reverter. The Journal of Biological Chemistry, Vol. 287, Issue 12, 9250-9258, MARCH 16, 2012. DOI 10.1074/jbc.M111.330100


