Importants avenços en l'estudi de proteïnes transportadores de membrana
Totes les cèl·lules necessiten intercanviar ions i molècules petites amb el seu entorn. Aquest intercanvi té lloc d'una manera controlada mitjançant proteïnes transportadores de membrana, situades en la membrana cel·lular. Un subgrup important d'aquestes proteïnes el formen les proteïnes transportadores actives, les quals utilitzen energia per transportar el substrat en contra del seu gradient de concentració. Un exemple destacat són les proteïnes transportadores de sucre. Aquestes proteïnes utilitzen l'energia provinent de gradients iònics (normalment de sodi) o de protons, per transportar les molècules de sucre al citoplasma cel·lular. Es tracta, doncs, d'un co-transport catió-sucre.
Aquests co-transportadors actuen com un conjunt de vàlvules que en diferents etapes facilita el pas del sucre i del catió sodi des del periplasma al citoplasma. El mecanisme de transport contempla una sèrie de canvis conformacionals que orienten la proteïna cap el costat periplasmàtic, permetent la unió del sodi i després del sucre, seguits d'una reorientació cap a l'espai citoplasmàtic, on s'allibera el sucre i després el sodi. Aquesta alternança en l'accessibilitat del lloc d'unió dels substrats és un mecanisme comú a moltes proteïnes transportadores de membrana, i està presumiblement relacionada amb canvis d'orientació d'algunes de les seves hèlix transmembrana.
Com a primera aproximació a l'estudi del paper de la reorientació de les hèlices transmembrana en la funció de les proteïnes transportadores, s'ha estudiat una proteïna de membrana model, la bacteriorodopsina. Aquesta proteïna de 7 hèlix α transmembrana és un transportador actiu primari que transporta protons mitjançant l'energia de la llum. Per esbrinar quin paper juguen els moviments de les hèlix transmembrana, s'han introduït dos residus de cisteïna en llocs estratègics al final de dues hèlix adjacents, mitjançant mutagènesi dirigida. Induint la formació d'un pont disofre, s'aconsegueix restringir el moviment d'aquesta part de les hèlix. Utilitzant diverses metodologies, l'anàlisi de la funció d'aquesta proteïna modificada en comparació a la proteïna nativa, revela que les hèlix transmembrana es mouen com un cos rígid (1). Aquesta conclusió es pot extrapolar a d'altres proteïnes de membrana, com el conjunt de receptors acoblats a proteïna-G (de 7 hèlix α transmembrana), o proteïnes transmembrana transportadores. D'aquesta manera, aquest treball contribueix a entendre la forma en què les hèlix transmembrana d'aquest tipus de proteïnes es mouen per realitzar la seva funció.
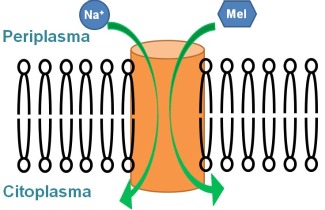
Per tal de revalidar aquest concepte en el cas d'una proteïna transportadora de molècules petites, s'ha estudiat el transportador de melibiosa. Es tracta d'una proteïna amb 12 hèlix transmembrana, que transporta el disacàrid melibiosa aprofitant un gradient de sodi. Utilitzant espectroscòpia de diferència d'infraroig polaritzat, s'ha demostrat que l'orientació de les hèlix transmembrana varia en unir el sodi i la melibiosa (2). Aquesta evidència reforça el concepte de que les hèlix dels transportadors actius es mouen com cossos rígids per dur a terme llur funció de transport.
Per altra banda, en un treball recent sobre el transportador de melibiosa, publicat al Proc. Natl. Acad. Sci. (3), s'ha investigat quins aminoàcids estan involucrats en la unió dels dos substrats (sodi i melibiosa). Utilitzant novament espectroscòpia de diferència d'infraroig, així com espectroscòpia de fluorescència, s'han detectat els canvis conformacionals produïts per la unió dels substrats. Comparant els resultats obtinguts de mutants seleccionats amb la proteïna nativa, s'han identificat 2 residus aspàrtic involucrats en la unió del sodi, i altres 2 residus aspàrtic que interaccionen amb la molècula de sucre. Mitjançant models estructurals del transportador de melibiosa, es pot predir la localització d'aquest aminoàcids clau en la unió dels substrat: els 4 aspàrtics es troben en 3 hèlix transmembrana diferents. Amb els resultats d'aquest treball (3), junt el treball de diferència d'infraroig polaritzat (2), es pot proposar que la unió dels substrats en la zona transmembrana provoca un canvi d’orientació en les hèlix α transmembrana.
Aquests estudis poden aportar coneixements claus per entendre el funcionament de transportadors homòlegs en humans, difícils d'estudiar directament degut a la complexitat de la seva purificació. Com a exemples més rellevant trobem: i) els transportadors de sodi-glucosa, responsables de la reabsorció de glucosa en les nefrones dels ronyons. La inhibició controlada d'aquests transportadors pot ser una bona estratègia per tractar la diabetis mitjançant l'increment en l'excreció de l'excés de glucosa per la orina. ii) Els facilitadors de glucosa, responsables de la difusió de la glucosa al citoplasma cel·lular. Aquestes proteïnes formen part de la família dels facilitadors majors de membrana, amb les que el transportador de melibiosa comparteix una estructura molt similar de 12 hèlix transmembrana i la capacitat de la unió de sucres.
Referències
1. Rosana Simón-Vázquez, Tzvetana Lazarova, Alex Perálvarez-Marín, José-Luis Bourdelande, and Esteve Padrós (2009) Cross-Linking of Transmembrane Helices Reveals a Rigid-Body Mechanism in Bacteriorhodopsin Transport. Angew. Chem. Int. Ed. 48, 1 – 4.
2. Víctor Lórenz-Fonfría, Meritxell Granell, Xavier León, Gérard Leblanc, and Esteve Padrós (2009) In-plane and out-of-plane infrared difference spectroscopy unravels helices tilt and structural changes in a membrane protein upon substrate binding. J. Amer. Chem. Soc. 131, 15094-15095.
3. Meritxell Granell, Xavier León, Gérard Leblanc, Esteve Padrós and Víctor Lórenz-Fonfría (2010) Structural insights into the activation mechanism of melibiose permease by sodium binding. Proc. Natl. Acad. Sci. USA doi:10.1073/pnas.1008649107.


