Administració de fàrmacs dirigits i teràpia oncològica
L'administració de fàrmacs dirigits a les cèl·lules malignes és especialment desitjable en la teràpia oncològica ja que actualment, el tractament convencional es basa en l'administració de fàrmacs quimioterapèutics no dirigits que es distribueixen per circulació sistèmica i que poden provocar l'aparició d'efectes adversos greus posant en perill la vida del pacient.
En aquest context, l'ús de vehicles dirigits que inclouen conjugat el fàrmac actiu (generalment nanopartícules d'una mida que varia de 10 a 100nm) permet una major concentració del fàrmac en el lloc d'acció i per tant, una major eficàcia del tractament. No obstant això, la naturalesa xenobiòtica i la toxicitat potencial de la majoria dels nanomaterials estudiats (polímers, ceràmiques, metalls i nanotubs de carboni entre d'altres) plantegen serioses preocupacions sobre la seva bioseguretat. Afortunadament, les nanobiotecnologies emergents estan impulsant fortament el desenvolupament de nanoestructures basades en proteïnes autoassemblants caracteritzades per ser materials totalment biocompatibles.
Les nanopartícules proteiques mostren una alta versatilitat funcional i poden actuar com a 'virus artificials', combinant en la mateixa entitat diferents funcions requerides per a un adequat adreçament del fàrmac, com per exemple, el reconeixement d'un marcador tumoral específic. En aquest context, T22 és un lligant altament selectiu del receptor de citocines CXCR4, sobreexpressat en aproximadament 20 neoplàsies humanes i que es correlaciona amb l'agressivitat i la metàstasi tumoral.
En estudis anteriors, hem descrit que la proteïna autoassemblant T22-GFP-H6 promou la formació de nanopartícules d'uns 12 nm i quan s'administra de forma sistèmica, mostra una biodistribució òptima en models animals de càncer colorectal, així com la unió selectiva i internalització en cèl·lules tumorals. Aquestes nanopartícules s'han utilitzat recentment com a potents transportadors de fàrmacs antitumorals convencionals i de proteïnes citotòxiques en diferents models animals de càncer, tots dos enfocaments amb alt impacte terapèutic.
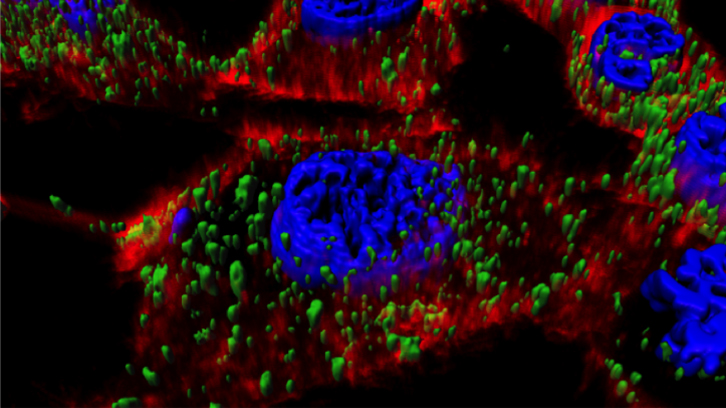
A causa de la flexibilitat d'aquesta plataforma, a més de dissenyar nanopartícules a la carta, permet optimitzar els nanoconjugats ja dissenyats per millorar la seva aplicabilitat com a portadors de fàrmacs. En aquest sentit, hem observat que la penetrabilitat de les nanopartícules T22-GFP-H6 és moderada a causa d’una escassa fuita endosomal i la conseqüent degradació lisosomal del mateix; un coll d'ampolla crític que limita l'administració eficient dels fàrmacs en el citoplasma cel·lular, tal com ja s'ha descrit per a molts altres nanomaterials proteics. D'acord amb això, la combinació de pèptids dirigits a les cèl·lules tumorals i potenciadors de la fuita endosomal podria oferir una estratègia per augmentar l'eficàcia del nanoconjugat en la cèl·lula diana.
En aquest treball hem estudiat l'activitat combinada de T22 i la d'una potent proteïna formadora de porus, el pèptid antimicrobià GWH1, que es mostra simultàniament en la superfície de les nanopartícules i que podria actuar com a domini d'escapament endosomal. Els resultats obtinguts demostren que la GWH1 té una potent activitat endosomolítica, augmentant la transfecció eficient de les nanopartícules en el citoplasma. No obstant això, l'especificitat d'unió a CXCR4 es veu lleugerament reduïda, però sense comprometre l'eficiència de les nanopartícules.
En conclusió, la combinació funcional proporcionada per pèptids que reconeixen receptors tumorals i pèptids endosomolítics és un enfocament prometedor per millorar l'eficàcia dels nanoconjugats intel·ligents dissenyats per al tractament del càncer.
Postdoctoral Researcher
Institut de Biotecnologia i de Biomedicina
CIBER-BBN
Universitat Autònoma de Barcelona1
Dra. Esther Vázquez
Researcher
Institut de Biotecnologia i de Biomedicina
Departament de Genètica i Microbiologia
CIBER-BBN
Universitat Autònoma de Barcelona2
Referències
Serna, Naroa & María Sanchez, Julieta & Unzueta, Ugutz & Sanchez-Garcia, Laura & Sánchez-Chardi, Alejandro & Mangues, Ramon & Vázquez, Esther & Villaverde Villaverde, Antonio. (2018). Recruiting potent membrane penetrability in tumor cell-targeted protein-only nanoparticles. Nanotechnology, 30. DOI: 10.1088/1361-6528/aaf959.


