Medicina y Salud
Desarrollado un virus artificial inocuo para terapia génica
Investigadores de la Unidad de Nanobiotecnología del Institut de Biotecnologia i Biomedicina (IBB) de la UAB, liderados por Antonio Villaverde, han logrado una alternativa al uso de los virus para la terapia génica. Los investigadores han sintetizado nanopartículas que actúan como virus artificiales, capaces de envolver fragmentos de ADN y liberarlos con objetivos terapéuticos, sin riesgo biológico, en el interior de las células diana.
Referencias
Unzueta, U.; Saccardo, P.; Domingo-Espín, J.; Cedano, J.; Conchillo-Solé, O.; García-Fruitós, E.; Céspedes, M.V.; Corchero, J.L.; Daura, X.; Mangues, R.; Ferrer-Miralles, N.; Villaverde, A.; Vázquez, E. Sheltering DNA in self-organizing, protein-only nano-shells as artificial viruses for gene delivery. Nanomedicine. 2014, vol. 10, num. 3, p. 535-41. doi: 10.1016/j.nano.2013.11.006.
La terapia génica no viral, la inserción de genes en el genoma con fines terapéuticos sin usar virus, y en general las nanomedicinas emergentes pretenden imitar las actividades virales en forma de nanopartículas modulables para la entrega de ácidos nucleicos y otros fármacos en las células diana.
Entre una gran diversidad de materiales testados, las proteínas son biocompatibles, biodegradables y, además, ofrecen un amplio espectro de funciones que se puede ajustar por ingeniería genética. Una versatilidad funcional que contrasta con el control casi nulo ejercido hasta el momento sobre la organización de los bloques estructurales diseñados de novo para formar complejos utilizando proteínas. Mientras que las nanopartículas de proteínas basadas en modelos naturales aprovechan las actividades de auto-ensamblaje de sus bloques estructurales evolutivamente optimizados, los monómeros de proteínas multifuncionales diseñados en su totalidad de novo no llegan a alcanzar una organización predefinida en la nanoescala.
Recientemente, el grupo del profesor Antonio Villaverde ha descubierto la combinación necesaria para que estas proteínas actúen como virus artificiales y puedan autoensamblarse formando nanopartículas proteicas regulares, capaces de penetrar en las células diana y alcanzar el núcleo de una manera muy eficiente. La clave es una combinación de un péptido catiónico además de una hexahistidina situados en los extremos amino y caboxi- terminal, respectivamente, de proteínas modulares.
Aunque estas nanopartículas proteicas unen eficientemente ADN plasmídico para la expresión posterior de esos transgenes y son herramientas muy prometedoras en la nanomedicina, su organización supramolecular ha estado hasta ahora sin explorar. En este artículo han demostrado cómo, en presencia de ADN, los contactos promovidos por la cola de hexahistidinas son capaces de adaptarse a reajustes estructurales, entre otros los que promueven una reorientación de los segmentos catiónicos en la superficie interna, que convierten oligómeros sencillos en estructuras supramoleculares más complejas, formando cubiertas proteicas cerradas, de manera similar a los virus. Las interacciones catiónicas parecen ser la fuerza motriz de la interacción primaria ADN-proteína, lo cual se traduce en la protección del ADN frente a las nucleasas externas.
Mediante el autoensamblaje de las R9-GFP-H6 con extremos catiónicos, se obtienen espontáneamente dos modelos arquitectónicos, el isométrico y el helicoidal, como los que se observan en los virus naturales, que protegen de manera eficiente el ADN externo dentro de una cáscara proteica. Esta doble conformación estructural en la escala nano recuerda la organización de las proteínas virales.
Es importante destacar que la capacidad de los dominios catiónicos terminales para promover el auto-ensamblaje proteico parece ser independiente de la proteína estructural elegida (en este caso se eligió GFP pero también se han hecho estudios con proteínas estructuralmente diferentes), o por lo menos no parece limitado a un tipo de proteína en particular. Esto abre la oportunidad de seleccionar candidatos de proteínas homólogas no inmunogénicas como bloques de construcción de las nanopartículas, con el fin de evitar cualquier respuesta inmune tras la administración sistémica, que podría ser un punto crítico para el uso terapéutico de los virus artificiales basados en proteínas auto-ensamblables diseñadas de novo.
En resumen, se ha demostrado por primera vez cómo los virus artificiales basados en proteínas, es decir, las nanopartículas funcionales formadas por proteínas auto-ensamblables capaces de envolver eficazmente un núcleo de ADN, pueden ser generados por el diseño totalmente de novo de bloques arquitectónicos. Este hecho no sólo valida R9 y H6 como péptidos pleiotrópicos en vehículos para la terapia génica no viral, sino que también revela un potencial arquitectónico inesperado de estos dominios en la generación de proteínas modulables, cuyas propiedades se pueden ajustar adicionalmente mediante ingeniería de proteínas convencional. Estos agentes versátiles son alternativas prometedoras a las nanopartículas proteicas naturales, incluidas los virus, que debido a varias limitaciones, incluyendo la arquitectura rígida y los temas de bioseguridad, pueden resultar menos adecuados para su uso en nanomedicina.
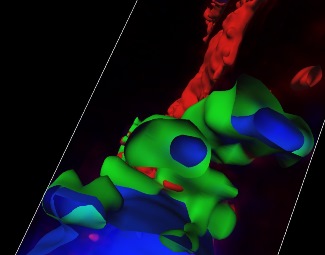
Figura superior izquierda. Reconstrucción en 3D de secciones en serie de microscopía confocal que muestran nanopartículas ADN-proteína en las que se aprecia el ADN (interno) en azul, y la proteína (externa) en verde.
Antonio Villaverde
Esther Vázquez
Departamento de Genética y Microbiología
Instituto de Biotecnología y de Biomedicina "Vicent Villar Palasí" (IBB)
2024 Universitat Autònoma de Barcelona
B.11870-2012 ISSN: 2014-6388
