Diseñan bioestructuras mínimas para crear nanomateriales
14/06/2018
Investigadores del Instituto de Biotecnología y de Biomedicina (IBB-UAB) han generado 4 péptidos -moléculas más pequeñas que las proteínas- capaces de auto-ensamblarse de manera controlada para formar nanomateriales. La investigación, publicada en la revista ACS Nano, ha sido realizada por Salvador Ventura, Marta Díaz y Susanna Navarro (IBB-UAB) y ha contado con la colaboración de Isabel Fuentes y Francesc Teixidor (Instituto de Ciencia de los Materiales de Barcelona, ICMAB-CSIC).
Las nuevas moléculas están formadas por una cadena de 7 aminoácidos, cada una de ellas utilizando sólo dos tipos diferentes, lo que agiliza y abarata significativamente los procesos de creación de estructuras amiloides sintéticas funcionales para fabricar nanomateriales de aplicación en biomedicina y nanotecnología.
En biotecnología, generar estructuras amiloides sintéticas para formar nanoestructuras inspirándose en cómo se crean de manera natural no es nuevo. El ensamblaje de proteínas en fibras estables permite generar arquitecturas supramoleculares que ninguna proteína aislada puede lograr y que se usan como nanoconductores, como estructuras fotovoltaicas, biosensores o catalizadores.
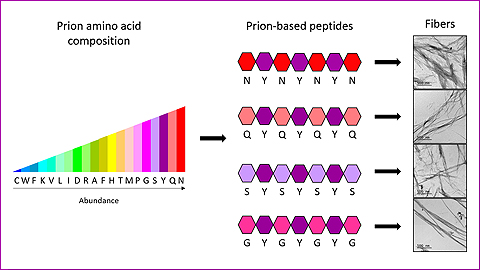
Muy recientemente, se han imitado secuencias de proteínas priónicas –también amiloides- para formar nanomateriales. El interés de estas secuencias radica en que se ensamblan de manera más lenta y controlada, formando nanoestructuras muy ordenadas y no tóxicas. Pero al ser secuencias muy largas, de más de 150 aminoácidos, resultan muy difíciles y caras de sintetizar.
“Con nuestro trabajo hemos demostrado que con un diseño adecuado la medida de las secuencias priónicas sintéticas se puede reducir hasta sólo 7 aminoácidos, conservando las mismas propiedades. Los 4 péptidos que hemos fabricado son las estructuras más cortas de este tipo logradas hasta ahora capaces de formar ensamblajes fibrilares estables”, explica Salvador Ventura, investigador del IBB y del Departamento de Bioquímica y Biología Molecular de la UAB.
Ejemplos que demuestran su eficacia
En su trabajo, los investigadores han comprobado la estabilidad y funcionalidad de los cuatro péptidos fabricados. Han construido uno de los nanomateriales de carácter biológico más resistentes a la degradación descritos hasta ahora, unos nanocables recubiertos con plata que podrían actuar como nanoconductores eléctricos y unas minienzimas fibrilares capaces de catalizar la formación de nanomateriales orgánicos.
Las aplicaciones de las nuevas moléculas son múltiples, pero los investigadores las quieren centrar “en la generación de nanoconductores eléctricos, y aprovechar su conocimiento de la estructura amiloide para generar fibras sintéticas que puedan catalizar nuevas reacciones químicas. El objetivo final sería generar materiales híbridos peptídicos-inorgánicos que puedan hacer reacciones complejas, como las que hacen, por ejemplo, los fotosistemas de las plantas”, indica el investigador del IBB.
Las regiones de los priones, el quid de la cuestión
Para generar los nuevos péptidos, los investigadores del IBB se han basado en unas secuencias específicas de las proteínas priónicas, llamadas regiones de priones (PrDs). “Hemos estudiado qué aminoácidos son más frecuentes y cómo están distribuidos en estas regiones, demostrando que sólo con 4 tipos de diferentes distribuidos de manera específica, y combinados siempre con un mismo quinto tipo, es suficiente para tener el código completo que permite formar fibras priónicas sintéticas. De hecho, cada uno de los heptapéptidos diseñados (mini-PrDs) consta sólo de dos tipos diferentes de aminoácidos”, señala Salvador Ventura.
El trabajo demuestra la capacidad de ensamblarse de los mini-PrDs en nanoestructuras muy ordenadas, algo que se pensaba era imposible, debido a la gran presencia de aminoácidos polares. Los péptidos conseguidos son más polares que cualquier otro de medida similar utilizado hasta ahora para formar amiloides sintéticos, lo que permite, por ejemplo, su funcionamiento en las mismas condiciones que las enzimas naturales.
Con este estudio, los investigadores del grupo de Plegamiento de Proteínas y Enfermedades Conformacionales del IBB que dirige Salvador Ventura abren una nueva línea en su investigación, centrada en el diseño de nanomateriales.
“No hemos hecho nunca nanotecnología, pero a la vez siempre la hemos estado haciendo, porque nuestra fuerza radica en el conocimiento del mecanismo molecular del ensamblaje de proteínas en estructuras amiloides. Durante mucho tiempo hemos estado trabajando para elaborar estrategias que eviten este fenómeno en enfermedades neurodegenerativas. Este conocimiento nos ha permitido poder llegar a diseñar las nuevas moléculas que proponemos ahora para fabricar nuevos nanomateriales”, concluye Ventura.
Los péptidos se ensamblan para formar minienzimas capaces de catalizar la formación de nanomateriales como el polímero conductor polipirrol.
Referencia: Minimalist Prion-Inspired Polar Self-Assembling Peptides. Díaz-Caballero M, Navarro S, Fuentes I, Teixidor F, Ventura S. ACS Nano. 2018 doi: 10.1021/acsnano.8b00417. https://pubs.acs.org/doi/10.1021/acsnano.8b00417