Proteínas priones ayudan a las bacterias a sobrevivir
Los priones son un grupo específico de proteínas que presentan la singularidad de poder existir en dos conformaciones intercambiables, una forma soluble desordenada y una forma altamente estructurada de tipo beta-amiloide, transmisible mediante un mecanismo de auto-ensamblado. Actualmente se conoce que esta promiscuidad conformacional de los priones viene definida en regiones específicas de sus secuencias, conocidas como dominios prión.
Los dominios prión son a la vez suficientes y necesarios para la conversión de los priones y, en general, corresponden a segmentos de la proteína que se encuentran intrínsecamente desordenados, presentan un enriquecimiento en la composición de residuos asparagina y glutamina y una región de nucleación beta-amiloide específica.
Estudios bioinformáticos recientes han permitido detectar la presencia de proteínas portadoras de dominios prión en una gran variedad de organismos, que en conjunto engloban todos los reinos de la vida, de acuerdo con la idea de que los priones desarrollarían funciones celulares beneficiosas y que estas se encontrarían evolutivamente conservadas.
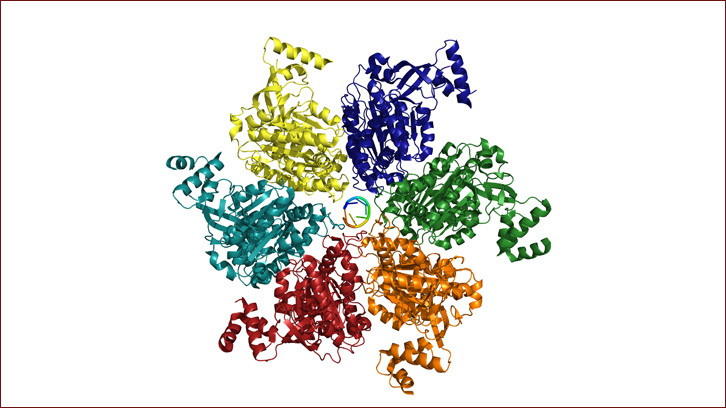
Nuestro grupo de investigación ha llevado a cabo un amplio estudio de análisis computacional, con el objetivo de identificar proteínas portadoras de dominios prión en proteomas bacterianos. Los resultados indican que a pesar de que la proporción de proteínas de tipos priónico en los proteomas bacterianos es en general baja, las especies patogénicas presentan una mayor carga priónica, sugiriendo que estas proteínas podrían tener un papel a la hora de favorecer las características patogénicas. El estudio más detallado del proteoma de la bacteria patógena Clostridium botulinum nos ha llevado, junto con el grupo de Hochschild y colaboradores, a la identificación del primer prión bacteriano. Se trata del factor finalizador de la transcripción Rho. Rho es una helicasa hexamérica altamente conservada, que desarrolla un papel central en el proceso de fin de la transcripción siendo esencial para la viabilidad celular y crucial en la capacidad de adaptación de la bacteria a entornos cambiantes.
Nuestro trabajo demuestra que la región identificada como dominio prión en esta proteína de unión a RNA es capaz de auto-ensamblarse de manera espontánea in vitro formando estructuras de tipo beta-amiloides canónicas. Este cambio conformacional se ha validado también in vivo, donde se ha visto que se transmite al conjunto de la proteína, dando lugar en consecuencia a dos conformaciones, la forma soluble de Rho que permitiría una finalización eficiente del proceso de la transcripción y una forma priónica donde se vería comprometida su función y que comportaría grandes cambios a nivel del trancriptoma de la bacteria.
Universidad Autónoma de Barcelona
Referencias
Pallarès I., Ventura S. The Transcription Terminator Rho: A First Bacterial Prion. Trends Microbiol. 2017 Jun;25(6):434-437. doi: 10.1016/j.tim.2017.03.008. Epub 2017 Apr 6.


