El mecanismo de activación de una proteína termófila
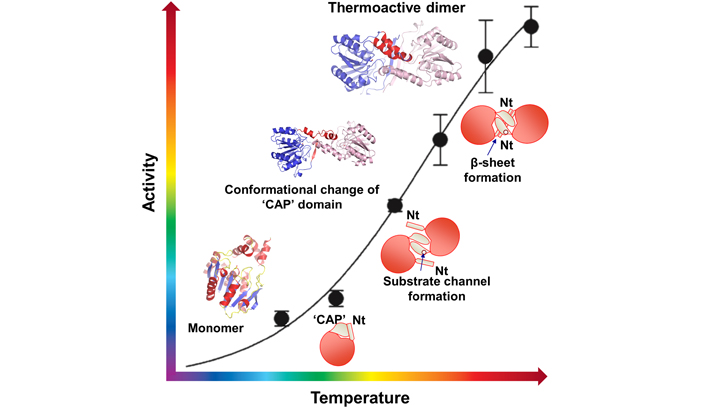
Las enzimas esterasas y lipasas son importantes biocatalizadores en el ámbito industrial y biotecnológico, ya que pueden romper de forma específica un tipo de enlace químico presente en casi todos los tipos de grasas. Estas enzimas se encuentran en casi todos los dominios de la vida, incluyendo animales, plantas, bacterias y virus. Concretamente el equipo del IBB ha trabajado con un miembro de esta familia de esterasas de un organismo termófilo denominado Pyrococcus furiosus, que es capaz de sobrevivir en condiciones extremas de temperatura hasta los 100 grados centígrados. Este hecho hace muy atractivo el uso de estos biocatalizadores en la industria, donde muchas veces los procesos se realizan a temperaturas extremas, como en el caso de la industria textil, donde lipasas y esterasas de organismos termófilos juegan un papel muy importante como el lavado por eliminación de grasas.
El trabajo presentado es la caracterización de la actividad biológica desde un punto de vista estructural de esta esterasa termófila de Pyrococcus furiosus, en la que se produce un proceso de activación de su actividad biológica a medida que aumentan de temperatura. Concretamente a temperaturas bajas, esta proteína casi no tiene actividad esterasa, pero al llegar a 70-80 grados, ya cerca de la temperatura a la que vive el organismo termófilo, se alcanza el máximo rendimiento en la actividad biológica. En este trabajo, publicado en la revista Structure, se presentan tres estructuras tridimensionales de esta proteína que presentan diferentes estados funcionales de la proteína. A bajas temperaturas, esta esterasa es inactiva y presenta una estructura tridimensional monomérica, pero a medida que aumentamos la temperatura, se produce un proceso de dimerización que hace que la esterasa adquiera el máximo de eficiencia de su actividad biológica a 70-80 grados.
Este mecanismo de regulación de la actividad por temperatura es una característica única de esta esterasa/lipasa que podría ser de gran importancia en la industria biotecnólogica por poder regular su actividad. Este trabajo se ha realizado en colaboración con el sincrotrón ALBA, donde se ha utilizado la luz del sincrotrón para resolver la estructura tridimensional.
Departamento de Bioquímica y Biología Molecular
Universidad Autónoma de Barcelona
Referencias
Referència: Varejão, N., De-Andrade, R.A., Almeida, R.V., Anobom, C.D., Foguel, D. & Reverter D. (2017). Structural Mechanism for the Temperature-Dependent Activation of the Hyperthermophilic Pf2001 Esterase. Structure. S0969-2126(17), 30403-30413. DOI: 10.1016/j.str.2017.12.004


